Корма и кормление камчатского краба
Известно, что качественный и количественный состав пищи — важные определяющие факторы выживаемости, роста и развития лиIMHOK Kpa6oB Sulkin, 1975a; Sulkin, Epifanio, 1975; Incze, Paul, 1983; Sulkin, McKeen, 1999 и др.]. Высокая смертность личинок камчатского краба на ранних стадиях развития во многом обусловлена недостаточностью энергетической ценности корма (Paul et al., 1989).
B IIpoBeJIeHIHIbIx Bo BHIMPO (2000—2007 TT.) 3KcIIepMIMeHTax B ycтановках замкнутого цикла водообеспечения, кормление личинок (зоэa I) начинали с 1-ого дня после выклева. Н.А. Зубкова [1964] начинала кормление через 3—4 дня после выклева, что вызывало увеличение смертности на первой стадии. В наших экспериментах, при содержании личинок без корма 60% особей погибли на 10-e CyTKM.
Артемия. В лабораторных условиях традиционно используемый для личинок ракообразных корм — науплии артемии (Kurata, 1960; Nakanishi, 1987; KoBaueBa, 2000, 2002, KoBaueBa, 2003; KoBaueBa, Eпельбаум, 2003; Ереlbaum, Kovatcheva, 2005). Науплии артемии — высококалорийный, удобный в использовании и наименее трудоемкий в культуре живой корм.
В ходе наших экспериментов 2000—2007 гг., в качестве основного корма использовали науплии артемии (Ковачева, 2000, 2001, 2002; Коvatcheva, 2001; Ковачева, 2003; Ковачева, Епельбаум, 2003; Ковачева, 2004, Ереlbaum, Kovatcheva, 2005, Ковачева и др. 2005в и др.).
Науплии Artетia sр. получали путем инкубации цист, находящихся в состоянии криптобиоза (высушенных щадящим методом и хранящихся в вакууме).
В литературе известны устройства для очистки и отделения науплиевартемии от цист и примесей, используемые в аквакультуреличинок рыб (авторское свидетельство СССР No 888889; 1980 г., авторское свидетельство СССР No.1472011, 1989 г.). Однако эти способы трудоемки и имеют ряд недостатков. Один из основных недостатков — потеря науплиями жизнеспособности, что вызывает быстрое снижение их энергетической и биохимической ценности и отсутствие пищедобывательной реакции на мертвых науплиев со стороны объекта выращивания. Кроме этого, недостатком устройства является его низкая производительность.
С.В. Пономарев с соавторами (2002) разработали устройство для инкубации яиц артемии, состоящее из сосудов для инкубации и отделения науплиев от цист, сифона и компрессора. Устройство позволяет получать определенное количество науплиев, однако не обеспечивает эффективного отделения науплиев от цист, особенно при их низком исходном качестве (при вылуплении около 40%). Цисты заглатываются личинками гидробионтов, но не перевариваются, что может привести к закупорке кишечника. Кроме того, цисты скапливаются в выростных емкостях и загнивают, что приводит к ухудшеHMEO Kat{eCTBa BOJTESI.
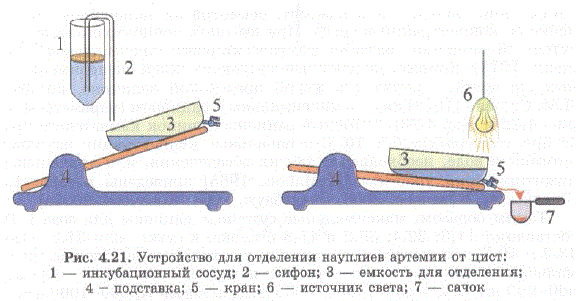
Для эффективного отделения при инкубации науплиев от цист и для повышения, при массовом производстве артемии, выхода жизне стойких науплиев без примеси невыклюнувшихся цист, нами было разработано устройство для инкубации яиц артемии, позволяющее с помощью специального сепаратора эффективно отделять науплиев от пустых оболочек и цист (рис. 4.21). Действие сепаратора основано на положительном фототаксисе науплиев и различиях в плотности науплиев и цист Патент No 40841, 2004 в Ковачева и др., 2005а.
Рис. 4.21. Устройство для отделения науплиевартемии от цист: 1 — инкубационный сосуд; 2 — сифон; 3 — емкость для отделения; 4 - подставка, 5 - кран, 6 - источник света, 7 - caчок
Личинки морских организмов имеют высокую потребность в полиненасыщенных жирных кислотах омега-3 ряда (эйкозопентаеновой 20:50-3 MJIOKo3arekcaeHOBoii. 22:6co-3) Watanabe et al., 1991; Tamaru, 1999; Suprayudi, 2004]. Для сохранения в живом корме полиненасыщенных жирных кислот, личинок камчатского краба кормили толькосвежими науплиями (24 часа инкубации), поскольку через 48 ч. инкубации пристандартной температуре, содержание в артемии полиненасыщенных жирных кислот падает в 2 раза. По данным П. Лавенс и П. Соржелос (Lavens, Sorgelos, 1996) при содержании живых науплиев при температуре 0—4. С в течение 1—2 суток, концентрация полиненасыщенных жирных кислот снижается незначительно. Используя это свойство, часть от свежевыклюнувшихся науплиев мы помещали в холодильник в аэрируемые емкости не более чем на 48 ч. Создание резерва живого корма значительно облегчает процесс культивирования.
Суточный рацион должен обеспечивать физиологические потребности организма. При этом нельзя допускать внесение избыточного корма, ухудшающего качество воды и увеличивающего риск возникновения бактериальных и грибковых инфекций (Zheng, Fang, 1998).
Одним из ключевых моментов любой биотехники является определение оптимальных суточных рационов, величина которых может существенно влиять на её экономическую эффективность.
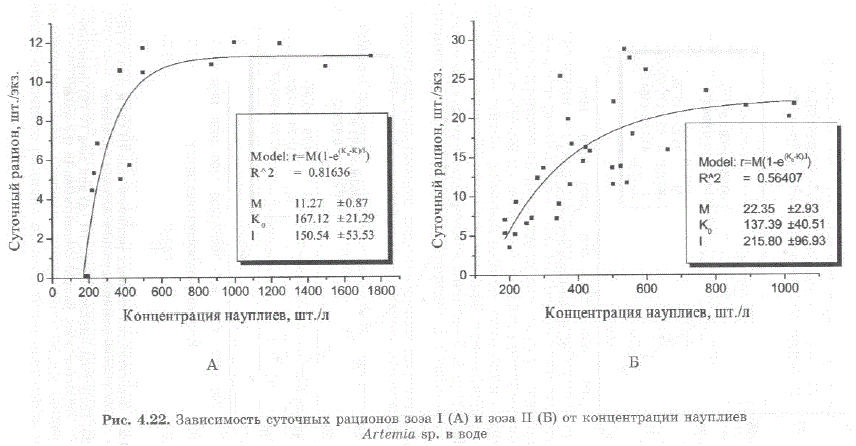
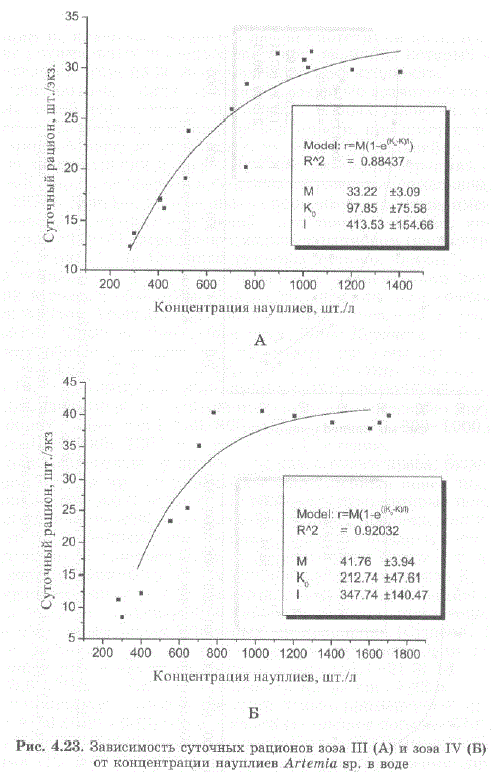
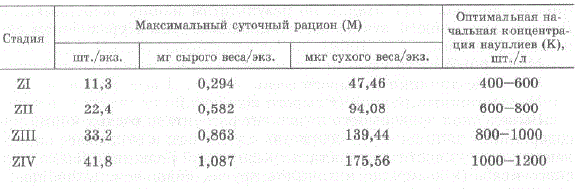
Максимальный рацион отражает предельные возможности пищедобывательной деятельности животных в данных условиях, т.е. физиологическое состояние полной насыщенности, при котором потребление пищи больше не возрастает, несмотря на дальнейшее увеличение ее концентрации в среде. При высоких концентрациях пищи, суточный рацион оказывается фактически равен максимальному (Сущеня, 1973). Кривые, полученные аппроксимацией экспериментальных значений, стремятся к некой предельной величине, которую Л.М. Сущеня (1973) назвал максимальным рационом (параметр M на рис. 4.2.2 и рис. 4.23). Суточные рационы личинок камчатского краба при температуре 6,5—10 C и начальные концентрации науплиев артемии в воде, необходимые для их обеспечения, или «начальный лимитирующий уровень» (McMahon, 1965) приведены в табл. 4.3 (Эпельбаум, Ковачева, 2003, Эпельбаум, 2004; Ковачева, 2006a).
Таким образом, максимальные суточные рационы для зоэa I—IV составляют 11,3; 22,4; 33,2 и 41,8 шт./экз. в сутки, или 34,2, 41,3, 43,2 и 40,7% от сырого веса личинки в сутки, соответственно. Оптимальная начальная концентрация науплиев составляет порядка 500—600 шт./л для зоэa I, 600—800 шт./л для зоэa II, 800—1000 шт./л для зоэa III и 1000—1200 шт./л для зоэa IV стадии.
В ходе наблюдения за личинками камчатского краба, было установлено, что для них не характерен направленный поиск корма — личинки захватывают лишь те пищевые объекты, которые попадают в район их ловчего аппарата. В соответствии с этим, они, как и большинство планктонных ракообразных, способны выедать корм лишь до определенной концентрации, не равной нулю. Поэтому в уравнение расчета величины суточных рационов введен параметр Ко, который отражает «минимальную непотребляемую концентрацию пищевых частиц», т.е. концентрацию пищевых объектов, при которой выедание их данным видом животных прекращается (Сущеня, 1973). Для зоэа камчатского краба I—IV стадий минимальная непотребляемая концентрация науплиевартемии равна 167, 1+21,3; 137,4+40,5; 97,9+75,6 и 212,7+47,6 шт./л (параметр Ко на рис. 4.22 и 4.23, значения и стандартное отклонение вычислены с применением программы MicroCal Origin 6.0), что в среднем составляет порядка 154 науплия на литр. Это приблизительно соответствует данным А.Пола с соавторами (Paul et al., 1989), полученным при кормлении личинок камчатского краба копеподами. Для того, чтобы зоэа захватывали не менее 1 копеподы в сутки, концентрация копепод должна составлять порядка 200 шт./л (Эпельбаум, 2005; Ковачева, 2005; Epelbaum, Kovatcheva, 2005).
Таблица 4.З. Максимальные суточные рационы зоэa I—IV стадий и оптимальные начальные концентрации науплиев
Для сравнения полученных нами для ракообразных суточных рационов с литературными данными, мы рассчитали теоретические величины рассматриваемого показателя для личинок камчатского краба I—IV стадий с учетом их веса по формуле, предложенной Л.М. Сущеня (1969). Рассчитав суточный рацион личинки в граммах сырого веса, и зная вес науплия артемии, мы определили теоретическое число науплиевартемии, потребляемое личинкой в сутки. Теоретические величины суточных рационов приведены в табл. 4.4,
Таблица 4.4. Теоретические значения суточных рационов личинок I—IV стадий при кормлении науплиями Artетia sр.
Как следует из табл. 4.3, 4.4, для стадии зоэа I экспериментальный суточный рацион практически равен теоретическому. Однако для зоэa II—IV стадий экспериментально установленный рацион превышает теоретический на 48,3%, 66,0% и 66,5%, соответственно.
Как отмечает Л.М. Сущеня, предложенное им общее уравнение для расчета суточного рациона по весу тела, дает лишь приближенное представление о средних величинах рациона у ракообразных — для каждого вида уравнение имеет несколько иной вид из-за ряда физиологических и экологических особенностей (Сущеня, 1973).
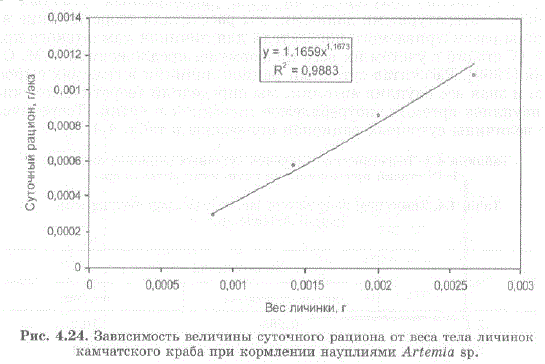
На рис. 4.24 приведена зависимость между весом и суточным рационом личинок I-IV стадий по результатам наших экспериментов. Данная зависимость лучше всего апроксимируется уравнением степенной функции:
M=1, 1659 W11678, rue
W — вес личинки (г. сырого веса),
M — суточный рацион (гсырого веса/экз.).
Выведенная зависимость позволяет рассчитать расход корма при содержании личинок в искусственных условиях и открывает определенные возможности для анализа трофической роли личинок камчатского краба (а возможно и личинок других видов сем. Lithodidae) в природных экосистемах.
Рис. 4.24. Зависимость величины суточного рациона от веса телаличинок камчатского краба при кормлении науплиями Artетia sр.
Литературных данных по потреблению науплиевартемии личинками камчатского краба сравнительно немного. Х. Курата (Kurata, 1960) в экспериментах по определению суточных рационов личинок камчатского краба при 8 C и 12 С установил, что при более высокой температуре период личиночного развития короче, а величина суточного рациона больше. За счет этого, за весь период развития одна личинка потребляет порядка 760 науплиев Artетia sр. при обеих температурах (Kurata, 1960). По нашим данным (см. табл. 4.3, 4,4) за весь период развития 1 личинка камчатского краба потребляет порядка 1043 науплия Artетia sр. Различия с литературными данными могут быть объяснены тем, что размер и вес науплиевартемии существенно различаются в зависимости от места сбора цист (Гусев, 1981, 1990; Литвиненко и др., 2000). Так, сухой вес науплия может составлять от 1,63 мкг (залив Сан-Франциско, США) до 4,55 мкг (озеро Айби, Китай) [Lavens, Sorgeloos, 1996].
Политературным данным циркадные ритмы питания отсутствуют, за исключением зоэa I, которая питается несколько активнее в ночHoe BpeMH C 21.00 Io 09.00 H. IKurata, 1960). T. HaKaHMIIIM INakanishi, 1987] исследовал потребление личинками камчатского краба науплиевартемии при различных температурах воды. Он установил, что при 8 °C личинки I—IV стадий потребляли от 12 до 58 науплиев за 1 сут. Однако эти эксперименты были поставлены с использованием лишь пяти личинок каждой стадии.
Другие корма (Other feeds). При культивировании личинок камчатского краба исследователями протестировано, кроме науплиевартемии, большое количество различных кормов. В качестве корма пробовали использовать водоросли Mit28chia sр., однако это привело к гибели личинок (Sato, Tanaka, 1949b). Проведены эксперименты по кормлению зоэа трохофорами пяти видов полихет, собранных вестественной среде. Наилучшие результаты достигнуты при кормлении JIMTHIMHoK Tpoxoq?opa MM ILIOJIMXeT Polydora sp. M. Phyllodoce groenlandiса: наблюдалось активное питание и заполнение пищеварительного тракта личинок. Однако при всех вариантах кормления выживаемость до стадии глаукотоэ не превысила 6,7% (Sato, Tanaka, 1949). Х.Курата (Kurata, 1959) изучал выживаемость зоэа при использовании различных типов живых кормов: диатомовых водорослей Skeletonema costatum, Tpoxodbop IoJIMxeT Chone teres M. Polydora sp. M науплиевартемии. При кормлении водорослью Skeletoпeтa costatит все личинки погибли при линьке на стадию зоэa II; при кормлении трохофорами Polydora sp. выживаемость личинок не превысила 18%. Наилучшие результаты достигнуты при кормлении личинок трохофорами полихет Chone teres (выживаемость до стадии глаукотоэ составила 52,7%), однако опыт по кормлению трохофорами полихет был поставлен с использованием лишь 20 личинок (Kurata, 1959). А. Пол с соавторами (Paul et al., 1989) проводили эксперименты по кормлению зоэa I камчатского краба копеподитными стадиями и взрослыми pat KaMM oTpH JI, Copepoda (Pseudocalanus spp., Acartia spp., Orthionia spp.) и науплиями балянусов. В ходе этих экспериментов установлено, что при концентрациях копепод 300 шт./л личинки питались неактивно и потребляли не более 2 копепод в сутки; авторы не приводят данные по выживаемости личинок по окончании эксперимента (Paul et al., 1979, 1989). Эти же авторы поставили опыты по кормлению зоэa I камчатского краба диатомовыми водорослями Thalassiosi
ra nordenskioldii, Chaetoceros spp. M. Skeletonema costatum. HaMJIy IIII.Me результаты достигнуты в эксперименте по кормлению диатомовой водорослью Т. пordenskioldiі при концентрации не менее 1800 кл./мл — выживаемость личинок до стадии зоэа II составила 75%, тогда как при кормлении другими водорослями выживаемость не превысила 16%, [[Paul et al., 1989).
Экспериментов по кормлению личинок крабов искусственными кормами было проведено сравнительно немного. D. Levine с соавторами (1982) показали, что добавление желатиновых микрокапсул, содержащих питательные вещества, в стандартный рацион личинок краба Eитурапореи8 depressus, состоящий из коловраток, повышало выживаемость личинок. Проведены эксперименты по кормлению личинок краба Erioheir sinensis микрокапсулами вместо обычного рациона, состоящего из науплиев артемии; в результате выживаемость личинок повысилась на 13,53% (Zhanget al., 1998). Также проведены опыты по кормлению личинок Portипиs tritиberculatи8 микрокапсулами как в качестве добавки к рациону из коловраток, так и в виде самостоятельного рациона. В первом случае выживаемость личинок оказалась сопоставимой, а во втором — несколько ниже, чем при кормлении науплиями артемии (Kamazawa et al., 1983).
C. CaTo M C. TaHaKa Sato, Tanaka, 1949b B 9KcIIepMMeHTax IIo Mcкусственному выращиванию личинок камчатского краба пробовали использовать в качестве корма яичный желток, сухое молоко (не содержащее сахара), мясо камчатского краба (сухое и вареное), сырую печень камчатского краба и трески, а также водоросли Nitzschia sр. Российские исследователи применяли яичный порошок, пищевые дрожжи, одноклеточные водоросли Monochrysis, Phaeodactylит и науплии артемии (Зубкова, 1964; Культивирование..., 1987; Иванов, Шербакова, 2005). Однако все корма, кроме последних, дали неудовлетворительные результаты выращивания. В литературе отсутствуют описания каких-либо других опытов по введению искусственных кормов в рацион личинок камчатского краба.
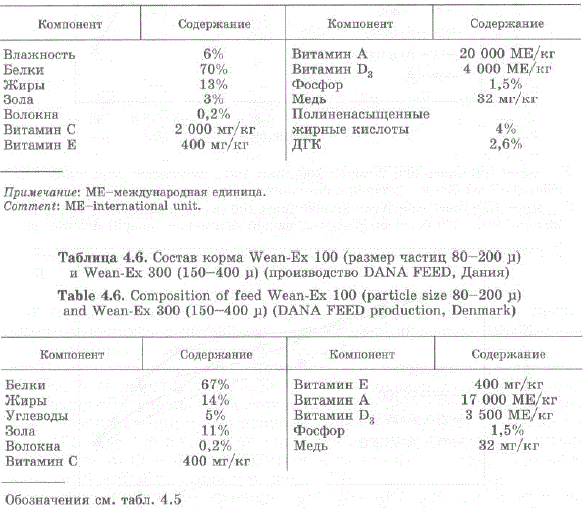
Для выявления эффективных личиночных кормов камчатского крабанами была поставлена серия экспериментов. Были испытаны искусственные стартовые комбикорма Start и Wean-Eх для морских организмов производства компании DANA FEED (Дания) как отдельно, так и в сочетании с науплиями Artетia salina [Эпельбаум, 2004; Эпельбаум и др., 2005; Ковачева, 2005). Состав кормов представлен в табл. 4.5 и 4,6. Эксперименты по использованию в рационе личинок комбикормов проводили на зоэa I и II, поскольку это наиболее уязвимые стадии в жизненном цикле камчатского краба и успех дальнейшего культивирования во многом зависит от должной обеспеченности этих стадий пищей (Paul et al., 1989; Ковачева, 2003; Ковачева и др., 2005в.
Таблица 4.5. Состав стартового корма для морских организмов Start 100 (размер частиц 90-200 ju) и Start 300 (размер частиц 150-400 ju)
(производство D.A.N.A FEED, Дания)
Примечание. МЕ-международная единица. Comment: ME-international unit.
Таблица 4.6. Состав корма Wean-Eх 100 (размер частиц 80—200 ju) и Wean-Ex 300 (150-400 р) (производство D.A.N.A EEED, Дания)
Обозначения см. табл. 4.5 Legends see on table 4.5
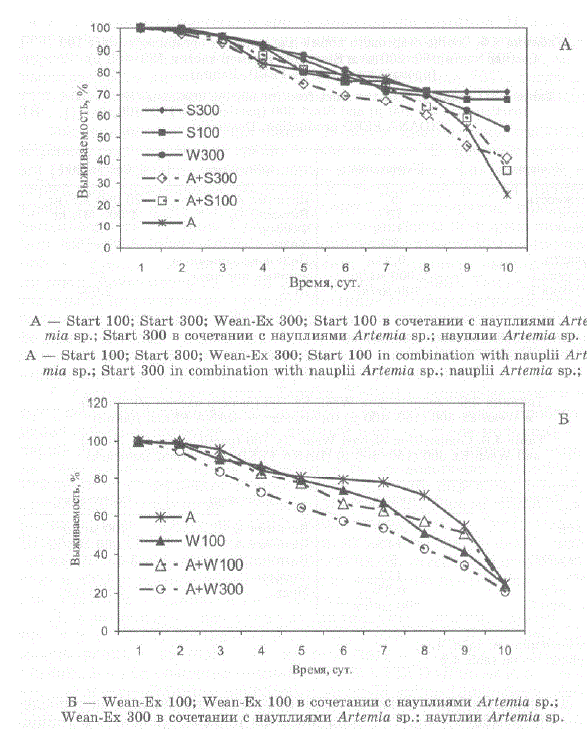
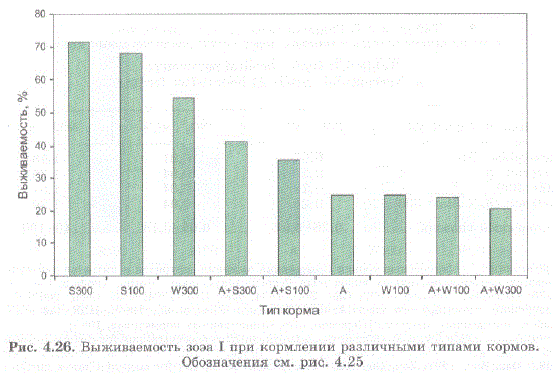
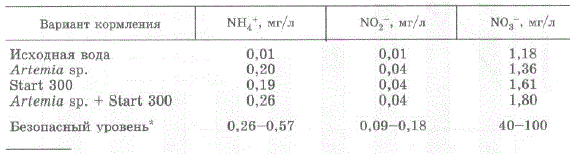
Личинки особенно активно питались в течение первого часа после внесения комбикормов, т.е. пока частицы корма оставались в толще воды. Наиболее высокая выживаемость наблюдалась при кормлении стартовыми комбикормами Start 300 и Start 100 — 71,4% и 68,0%, соответственно (рис. 4.25 A, B; рис. 4.26). При внесении этих кормов в сочетании с артемией выживаемость оказалась существенно ниже — 41% и 35,5%, соответственно. Возможно, это объясняется тем, что при внесении в воду одновременно науплиевартемии и сухого корма концентрация аммония и нитратов в воде возрастала по сравнению с
Рис. 4.26. Выживаемость зоэa I при кормлении различными типами кормов. Обозначения см. рис. 4.25
использовании каждого вида корма по отдельности, хотя и не превышала имеющихся в литературе данных по безопасным уровням для личинок морских декапод (табл. 4.7).
Наибольшая смертность личинок во всех экспериментах наблюдалась на 7—10 день (см. рис. 4.25 А, Б), что совпадает сначалом линьки. Около 90% погибших в этот период личинок находились в предлиночном состоянии или в процессе линьки. У первых отмечено начало образования нового карапакса под старым. Вторые, как правило, не могли полностью освободиться от старого экзувия в области карапакса и/илительсона (см. рис. 4.16).
37,3% личинок, получавших кормWean-Ex 300, ИМели Морфологические отклонения (см. рис. 4.2): по внешнему виду эти личинки были похожи на презоэа, но имели развернувшийся рострум. У них отмечены вполне развитые мандибулы. Однако щетинки на максиллах как первой, так и второй пары развернулись не до конца, а внутри максилл начали развиваться максиллы следующей личиночной стадии. Их перистые гребные щетинки максиллипед были ввернуты внутрь, как на стадии презоэа.
Эксперимент с зоэa I завершили после перехода морфологически полноценных особей на стадию зоэa II.
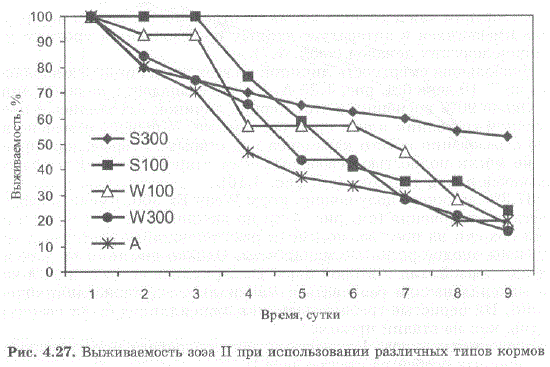
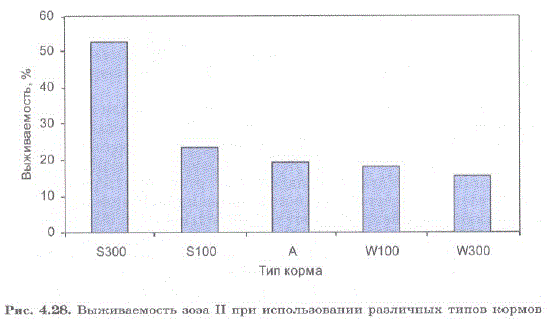
Выживаемость личинок в ходе экспериментов с зоэa II представлена на рис. 4.27, 4.28.
Таблица 4.7. Гидрохимические показатели воды в экспериментальных емкостях через сутки после внесения корма
IIPL.Me"La H. Le: * безопасные уровни содержания аммония, нитритов и нитратов для личинок морских креветок различных видов рода Рenaeus [Jayasankar, Muthu, 1983a,b; Chen, Chin, 1988; Ostrenzky, Poersch, 1992; Gao, Zou, 1994; Zou, Gao, 1994; Tsai, Chen, 2002) M 3038 KMTaiickoro MoxHaTopy Koro Kpa6a Eriocheir sinensis (Zhao et al., 1997, IIIH I JIH Bo JoeMoE рыбохозяйственногозначения (Перечень рыбохозяйственных нормативов, 1999).
Notation: " - safe levels of ammonium, nitrates, nitrites concentrations for different species of sea shrimps genus Penaeus Jayasankar, Muthu, 1983a,b; Chen, Chin, 1988; Ostrenzky, Poersch, 1992; Gao, Zou, 1994; Zou, Gao, 1994; Tsai, Chen, 2002) and for zoea of Chinese mitten Crab
Eriocheir sinensis Zhao et al., 1997), maximum contamination level for fisheries waters List of fisheries standards, 1999).
Время, сутки
Рис. 4.27. Выживаемость зоэa II при использовании различных типов кормов Fig. 4.27. Survival rate of zoea II with different kinds of food
Рис. 4.28. Выживаемость зоэa II при использовании различных типов кормов Fig. 4.28. Survival rate of zoea II with different kinds of food
Как и на стадии зоэa I, наилучшая выживаемость личинок наблюдалась в экспериментах с кормом Start 300, причем при питании кормом Start 300 выживаемость возросла в 2,2 раза по сравнению с кормом Start 100. Выживаемость достадии глаукотоэсоставила 35% (максимальная достигнутая нами выживаемость при кормлении науплиями артемии составила в прежние годы 23—30,8%).
Все погибшие особи, получавшие корма Wean-Eх 100 и Wean-Ех 300, имели описанные выше морфологические отклонения (см. рис. 4.2.). Личинки, получавшие корма Start 100 и Start 300, развивались без морфологических отклонений.
При кормлении личинок искусственными кормами продолжительность развития и показатели роста (табл. 4.8) соответствовали усредненным данным, полученным в ходе многолетних экспериментов по кормлению науплиями артемии (Ковачева, 2002; Ковачева, Эпельбаум, 2003; Эпельбаум, 2004; Ковачева, 2005а; Эпельбаум и др., 2005).
Таблица 4.8. Рост и развитие личинок камчатского краба при кормлении искусственными кормами (Z I, Z II)
Из недостатков использованных в экспериментах комбикормов следует отметить, что корма лишь около 60 минут сохраняют плавучесть, затем оседают на дно и прилипают к нему. Дольше всего держится в толще воды (около 2 часов) и меньше прилипает ко дну корм Start 300.
Таким образом, среди протестированных кормов для зоэa I наилучшими оказались корма Start 300 и Start 100, а на стадии зоэa II — корм Start 300. Start 300 имеет более крупный размер частиц по сравнению с кормом Start 100. Вероятно, именно поэтому более крупные личинки второй стадии предпочитают этот корм, в результате чего возрастает эффективность его использования. Личинки первой стадии, по-видимому, не проявляют избирательность по отношению размера частиц в кормах Start 100 и 300, поэтому эффективность этих кормов для первой стадии почти одинакова. В кормах Wean Eх более высокое содержание золы по сравнению с кормами Start, и они лишь около получаса держатся в толще воды. Кроме того, в кормах Start более высокое содержание витаминов и имеются полиненасыщенные жирные кислоты омега-3 ряда (см. табл. 4.5 и 4.6). В литературе имеются данные по повышению выживаемости, темпа роста и улучшению физиологического состояния личинок некоторых видов крабов при питании различными кормовыми организмами (одноклеточными водораслями, коловрат ками, науплиями, Arteтia sp.), обогащенными специализированными эмульсиями или маслами с полиненасыщенными жирными кислотами [Urcera et al., 1993; Takeuchi et al., 1999a,b; Chen et al., 2000). В то же время, некоторые виды крабов не реагируют на питание кормами, обогащенными полиненасыщенными кислотами ряда омега-3, или даже гибнут от них [Kobayashi et al., 2000; Mann et al., 2001). В соответствии с этим, нельзя однозначно ответить на вопрос о том, является ли наличие эйкозопентаеновой и докозогексаеновой жирных кислот в корме Start одной из причин повышения выживаемости личинок. Возможным направлением дальнейших работ по созданию оптимальных кормов для камчатского краба должно стать исследование влияния полиненасыщенных жирных кислот на выживаемость, развитие и рост личинок. Другой важной задачей на будущее является повышение плавучести кормов.
Смотрите также