Скорости преобразования органического вещества и регенерации биогенных элементов в водах Охотского моря
Для оценки скоростей преобразования органического вещества (ОВ) в продукционно-деструкционном цикле и полноты использования вещества и энергии в метаболизме данной экосистемы проводят измерения активности тех или иных ферментов во фракции микропланктона. В данной работе представлены результаты измерений активности ферментов электрон-транспортной системы (ЭTC), катализирующих реакции передачи электронов от восстановленных субстратов на кислород, т.е. окисление OBдо СО, и H2O, и фермента щелочной фосфатазы, катализирующего реакцию гидролитического отщепления фосфата от фосфоорганических соединений. Измерения активности ферментов ЭТС позволяют оценить скорости потребления кислорода, т.е. гетеротрофную активность микропланктона [Packard, Williams, 1981], а измерения активности ферменT фосфатазы - скорости регенерации такого важного биогенного 3AeMeHTa, KaK минеральный qboc{pop IAraToBa M. Ap., 1985: Paasche, Erga, 1988; Venkateswaran, Natarajan, 1984]. A^3. CxơTCKoro моря и тихоокеанских вод в районе Курильской гряды такие исследования были проведены вперEse,
Материалы н методы
Исследования проводили в летний период 1992-1994 гг. в различных районах Охотского моря: в глубоководной его части, в области шельфа и склона Камчатки и Восточного Сахалина, в Сахалинском заливе и Прикурильском районе. Схема расположения биохимических станций представлена на рис.1 в статье "Биохимический состав взвешенного и растворенного органического вещества в Охотском море" (А.И.Агатова и др., наст.сб.).
Методики отбора проб воды и приготовления проб взвеси для определения в них активности вышеперечисленных ферментов подробно описаны ранее (Агатова, Лапина, 1995). Там же даны методы определения активности ферментов ЭТС и щелочной фосфатазы.
Ферментативные активности взвеси из одной пробы измеряли при двух температурах: максимальной и минимальной, наблюдавшихся в столбе воды при отборе проб. Результаты по скоростям ферментативных реакций были приведены к температуре in situ, исходя из соответствуюLIL HX ೫epಣೆ активации этих реакций, вычисленных по уравнению Аррениуса (Агатова, Лапина, 1994,
Результаты
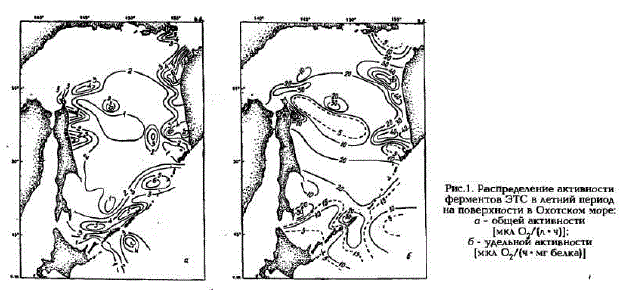
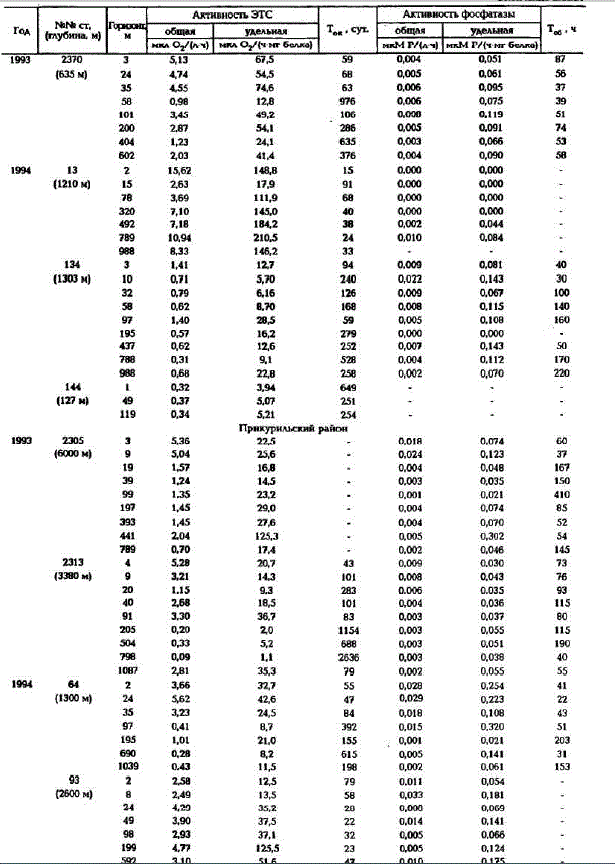
Активность ферментов ЭТС в Охотском море изменялась в больших пределах как на поверхноcти (рис.1.а,б), так и по вертикали (табл.1): значения общей активности ЭТС варыировали от аналитического нуля до 18,9 мкл О./(л-ч), а удельной - от 0 до 210,5 мкл О./(ч- мг белка).
Рис. 1. Распределение активности ферментов ЭТС в летний период на поверхности в Охотском море: о - общей активности [MKM OWN * t)]; б - удельной активности MKA О,/(ч *
Максимальные скорости потребления кислорода в 1992 г. были зарегистрированы на Сахалинском шельфе, а в 1994 г. - на шельфе Камчатки (см. табл.1). Минимальные значения активностей ЭТС характерны для центральной части моря, а на разрезе через центральную часть моря от о. Атласова (ст.2178) до о.Сахалин (ст.2188) активность ЭТС в поверхностном слое даже равнялась аналитическому нулю (см.табл.1).
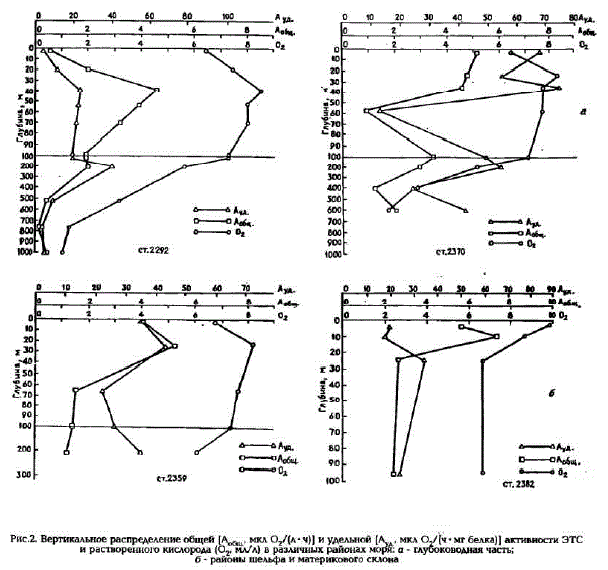
Рис.2. Вертикальное распределение общей (А. мкл о./(л-ч) и удельной (
KOBOWHA als
и растворенного кислорода (О, мл/л) в различных районах моря: о - гл
б-районы шельфа и материкового склона
В фотическом слое Прикурильского района летом 1993 и 1994 гг. скорости потребления кислорода в водах со стороны Охотского моря были в 2-3раза выше, чем втихоокеанских водах. Минимальные величины активностей ЭTC (0,2-0,8 мкл O2/(л - ч) отмечались на шельфовых станциях около о.Кунашир (ст.2279, 2280) и на глубоководной станции 2274.
Вертикальное распределение общей и удельной активностей ЭТС в Охотском море очень неоднородно. В глубоководной части моря, как правило, при вертикальном профиле наблюдаются два максимума скоростей потребления кислорода (рис.2,a): первый - под скачком плотности, в слое 20-50 м; второй - в слое максимальных градиентов кислорода. Такой же характер вертикального распределения зафиксирован и в проливах Курильской гряды.
В районах шельфа и материкового склона отмечался максимум общей активности ЭТС в слое 10 - 20 м и некоторое ее уменьшение с глубиной (см. рис.2.б). И лишь в районе банки Кашеварова наблюдали однородное вертикальное распределение значений скоростей потребления кислорода во всей толще вод (см.табл.1).
По скоростям потребления кислорода можно четко проследитъ влияние речных вод. Так, в Сахалинском заливе в зоне проникновения речных вод скорости потребления кислорода были в 4-5 раз больше, чем в морских водах, и максимальные значения общей активности ферментов ЭТС превышали здесь 20 мклО,/(л-ч).
Межгодовая изменчивость скоростей потребления кислорода в летний период проявляется неодинаково в различных районах моря. Наибольшая межгодовая изменчивость значений активности ферментов ЭТС характерна для шельфа Сахалина и банки Кашеварова, тогда как в центральной части моря и на Камчатском шельфе она незначительна, а в водах Курильской гряды ее выявить не удалось (см.табл.1).
Определение скоростей окислительно-восстановительных реакций, катализируемых ферментами ЭTC, и концентраций растворенного и взвешенного органического углерода
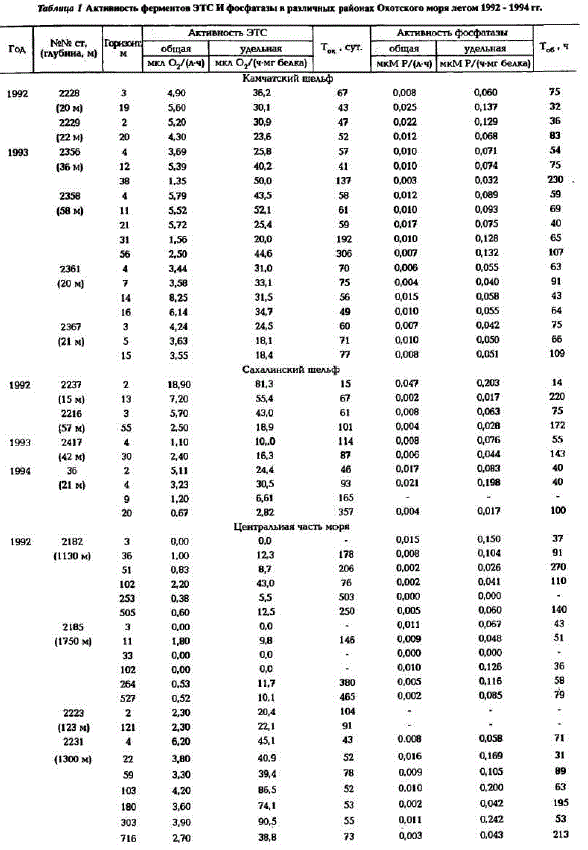
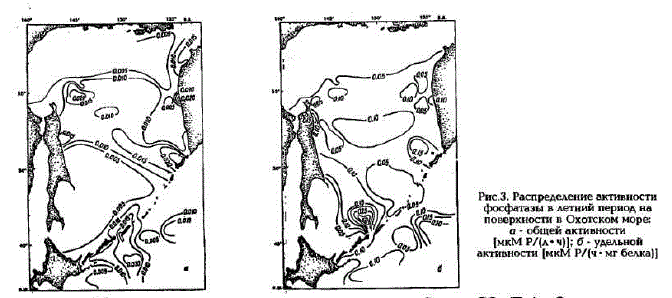
Рис.3... Pacпределение активности фосфатазы в летний период на поверхности в Охотском море: о - общей активности (мкMP/л в ч) б - удельной активности мкМ Ру(ч - мт белка)
и др., наст. сб.) позволило оценить время полного окисления C до СО, (Т) в Охотском море. Широкий диапазон изменений значений общей активности ферментов 3tö"。 море обусловил и большие колебания т - от 15 до 2636 сут (см.табл.1). В фотическом слое большинства станций время полного окисления си составляло в среднем 100 - 150 сут. На станциях разреза (ст.21782188) и ст.2274, 2280, где отмёчались минимальные скорости потребления кислорода, оно было более 500 сут. На станциях в районах Камчатского и Сахалинского шельфа- менее 50 сут.
Акпивность щелочной фосфатазы в Охотском море изменялась на поверхности в широких пределах: величины общей активности варьировали от 0,000 до 0,047 мкМ Р/(л - ч), а удельной активности - от 0,000 - 0,253 мкM P/(ч - мг белка) (рис.3; табл.1).
Наибольшая изменчивость скоростей расщепления фосфорорганических соединений характерна для фотического слоя. Здесь прослеживается прямая зависимость величин активности фосфатазы от концентрации минерального фосфора. На шельфе Сахалина и Камчатки, где содержание минерального фосфора в фотическом слое не превышало 0,10 мкMP, наблюдались высокие скорости расщепления фосфорорганических соединений (общая активность - 0,015 - 0,019 мкM P/(ч *л]]. В Прикурильском районе самая высокая активностъ, как общая (0,024 мкMP/(ч-л)), так и удельная (0,124 мкMP/(ч- мг белка)), отмечалась при концентрациях минерального фосфора, равных аналитическому нулю.
В Восточно-Сахалинском и Западно-Камчатском районах по мере удаления от шельфа в открытую часть моря скорости регенерации фосфатов в фотическом слое уменьшались (см. рис.3). Например, в 1993 г. в первом из вышеуказанных районов общая активность фосфатазы изменялась от 0,012 до 0,006 мкМ Р/(л.-ч), а во втором - от 0,010 до 0,004 мкМ Р/(л - ч), также уменьшались и значения удельных активностей - от 0,090 до 0,060 мкM P/(ч - мг белка) и от 0,076 до 0,030 мкM P/(ч - мг белка) соответственно. При этом концентрации минерального фосфора изменялись незначительно, не более чем на 0,007 мкМ Р.
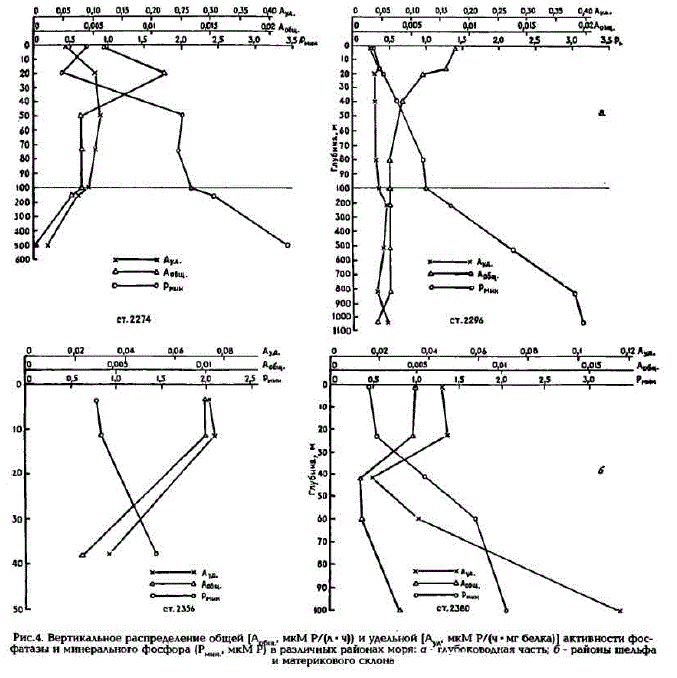
Вертикальное распределение величин фосфатазной активности в фотическом слое глубоководной части Охотского моря и на его шельфе находится в обратной зависимости от распределения минерального фосфора (рис.4, а, б). При увеличении концентраций минерального фосфора с глубиной значения общей активности фосфатазы уменьшаются в среднем в 5 - 10 раз. В пелагиали же, в теплом и холодном промежуточных слоях (ТПС и ХПС), часто можно наблюдать значительное увеличение общей и удельной активности фосфатазы по сравнению с выше- и нижележащими слоями воды (см.табл.1).
Следует отметить, что в районах материкового склона Камчатки, и особенно Сахалина, скорости регенерации фосфатов из фосфорорганических соединений практически равны нулю в слое 0 - 15 м, а на юго-восточном склоне Сахалина они равнялись аналитическому нулю во всей толIЦе ВОД
В Сахалинском заливе по распределению величин фосфатазной активности можно выделить зону проникновения амурского стока. Здесь, так же как и в случае с ферментами ЭTC, активность фосфатазы возрастает в 3-4 раза.
Межгодовая изменчивость скоростей регенерации фосфатов из фосфорорганических соединений в летний период наиболее ярко выражена вводах Сахалинского залива и Прикурильского района. В Сахалинском заливе значения общей и удельной активности фосфатазы были в 1992 г. в 2-3 раза выше, чем в 1993 г. В свою очередь в Прикурильском районе не только в фотическом слое, но и в ТПС и ХПС эти показатели были в 1993 г. в 2 - 4 раза ниже, чем в 1994 г. Межгодовая изменчивость скоростей реакций, катализируемых щелочными фосфатазами, на Камчатрком и Сахалинском шельфах была незначительной (см.табл.1).
Исходя из измеренных величин фосфатазной активности и концентраций органического фосфора, было подсчитановремя минерализации фосфора (Тб) (см.табл.1). В среднем минерализация фосфорорганических соединений происходила на шельфовых станциях около о.Кунашир за 40-50 ч; на шельфовых станциях Западной Камчатки и Восточного Сахалина и в фотическом слое станций Прикурильского района с охотоморской стороны - за 60 - 80 ч; на мористых участках
Рис.4. Вертикальное распределение общей (А MKM P/(m · Y)). Ka удельной (Ay MKMP/{V - MT6eARa]] arTMBHOCTH pocфатазы и минерального фосфора (Р. мкMP) в различных районах моря: a "Tлубоководная частъ, б- районы шельфа и материкового склона
в фотическом слое составляло около 100 ч, а в глубинных слоях - 150 - 200 ч. В Сахалинском заливе в зоне смешения морских и речных вод минерализация фосфора происходит в среднем за 40 - 60 ч, в то время как в остальной части залива - за 90 - 120 ч.
Рассчитанные по уравнению Аррениуса для области температур 1 - 19°C энергии активации реакций, катализируемых ферментами ЭТС и щелочной фосфатазы, оказались довольно низкими (3 - 6 ккал/моль) не только для микрогетеротрофов, но и для тех видов зоопланктона (Calanus LLLTCCS CTMaaLCC TTTMMLCCS LLLCCLMaGLC TCGMMCCCS CCCCCCaCCSCTTGGLLCCMMCLLC CCCCLLGGS C CCLCCCCLCL CCC измеряли активность этих ферментов. Однако летом 1994 г. на Сахалинском шельфе и за пределами 1000-метровой изобаты, особенно в фотическом слое, величины энергии активации как для ферментов ЭTC, таки для фосфатазы были высокими - в пределах 12 - 14 ккал/моль и 16 - 23 ккал/моль соответственно. В то же время в этих районаху зоопланктона энергии активаций осTal Ba MKCI MOBIOMELHO HM 3KLMMM.
Летом 1993 г. впервые для вод Охотского моря активности ферментов ЭТС и щелочной фосфатазы были измерены в поверхностном микрослое (ПМС). Как видно из табл.2, в ПМС общая активность ферментов обоих классов значительно выше (в 2 - 10 раз), чем в водах под этим слоем. Величины же удельной активности ферментов ЭТС и щелочной фосфатазы не всегда выше, чем в подстилающем слое, а иногда даже значительно ниже. Очень высокие значения общих активностей в ПМС приводят к уменьшению времени оборота в продукционно-деструкционном цикле углерода и фосфора в этом слое (см.табл.2).
Таблица2. Амтнвность ферментов ЭТС и щелочной фосфатазы в поверхностном микрослое н подстнлающем слое 00-0,5м в Охотсмом море летом 1993 г.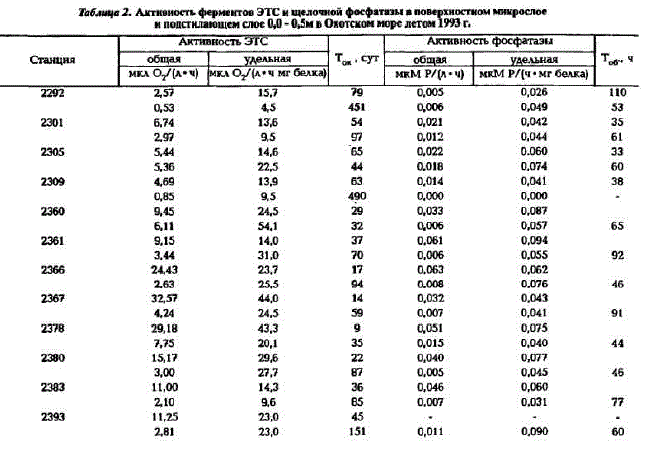
Величины общей активности исследованных ферментов зависят от количества данного фермента и от его удельной активности, поэтому изменение этих величин в морской среде происходит как за счет изменений биомассы гетеротрофного микропланктона и соотношения гетеротрофных и автотрофных организмов, так и собственно активности фермента, которая обусловлена воздействием целого ряда внутри- и внеклеточных активаторов и ингибиторов.
Наблюдаемые колебания величин активности ферментов ЭTC, особенно значительные в фотическом слое, связаны как со степенью активирования процесса потребления кислорода отдельной клеткой, так и с изменением доли гетеротрофных организмов в популяции микропланктона, потребляющих кислород. Поэтому, как правило, в этом слое увеличение удельной активности приводит к повышению и общей активности.
Самые высокие скорости потребления кислорода в фотическом слое отмечены для вод, которые характеризуются повышенной первичной продуктивностью (Налетова и др., наст. сб.), например, охотоморские воды в Прикурильском районе, на входе в залив Шелихова и в северо-восточной части шельфа Сахалина (см. рис.1). Создается впечатление, что активные продукционные процессы инициируют и активные деструкционные процессы, причем, как правило, пик максимальной активности ферментов ЭТС расположен ниже на 5 - 10 м максимума первичной продукции. Именно этим можно объяснить нулевые значения скоростей потребления кислорода в поверхностном слое и довольно высокие их значения в слое 10 - 20м в ряде районов Охотского моря. Наиболее ярко это выражено на разрезе от о.Атласова до о.Сахалин через центральную часть моря, где первичное продуцирование происходило в основном в поверхностном слое. Аналогичные результаты были получены нами и для вод Берингова моря (Агатова, Лапина, 1995).
Разные причины изменения активности ферментов ЭТС хорошо иллюстрируются данными, полученными на разрезе от м.Хайрюзово до м.Евреинова в северо-восточной части моря (см. рис.1.а). Так, по-видимому уменьшение общей активности до середины разреза происходило за счет падения биомассы гетеротрофного микропланктона, а у мыса Евреинова - за счет возрастания в популяции доли автотрофного планктона, что привело к понижению удельной активности потребления кислорода (см.рис.1, б).
Более высокие скорости потребления кислорода в Прикурильском районе со стороны Охотского моря, по сравнению со скоростями в водах со стороны Тихого океана, можно объяснить более высокой окислительно-восстановительной способностью популяции охотоморского микропланктона. На это указывает тот факт, что увеличение общей активности ферментов ЭTC здесь происходит за счет повышения их удельной активности.
Причины изменения активности ферментов ЭТС по вертикали (см. рис.2) разные: в верхнем слое (примерно до 50 м) определяющую роль играет соотношение автотрофных и гетеротрофных организмов в популяции планктона; в более глубоких слоях изменение активности, как правило,
определяется изменением концентрации гетеротрофов. Последнее хорошо видно на примере ХПС. Для этого слоя характерны минимальные значения общей активности ЭTC, что обусловлено в основном уменьшением биомассы гетеротрофного микропланктона, так как значения удельных активностей здесь даже выше, чем в фотическом слое, а концентрации взвешенного белка ниже (Агатова и др., наст.сб.). Величина удельной активности колеблется не только при изменении состава популяции планктона, но и при активации и ингибировании ферментов ЭTC. Поэтому естественно, что не во всех районах максимум удельной активности ферментов ЭTC наблюдается глубже нижней границы фотического слоя (ниже 50 м).
Второй значительный максимум активности ферментов ЭTC, расположенный в слое максимальных градиентов кислорода (см. рис.2,a), обусловлен не скоплением здесь микрогетеротрофов, а интенсификацией ими процесса потребления кислорода. На это указывает значительное увеличение в данном слое удельной активности ферментов ЭТС при практически неизменной биомассе гетеротрофов (концентрации взвешенного белка почти не меняются).
Интересно, что скорость потребления кислорода, как правило, изменяется в градиентных зонах, например, в скачке плотности, на границе ТПС и ХПС, в слое минимума кислорода и в зонах смешения водразного генезиса (Агатова, Лапина, 1995). По данным, полученным для Сахалинского залива, хорошо выделяется зона смешения речных и морских вод, так как в ней увеличивается скорость потребления кислорода как за счет увеличения биомассы микрогетеротрофов в 2 - 3 раза, так и за счет повышения удельной активности ферментов ЭТС в 1,5 - 4 раза. Здесь, так же как и в случае с Анадырским заливом Берингова моря (Агатова, Лапина, 1995), происходит смена популяционного состава микропланктона, в котором преобладающую роль начинает играть гетеротрофный планктон. С этой точки зрения интересен факт перехода именно в данной части залива фитопланктона на гетеротрофное питание (Микаэлян, 1993, частное сообщение). Таким образом, здесь создается активный гетеротрофный барьер для быстрой ассимиляции ве-ществ, поступающих с речным стоком.
Величины активности щелочной фосфатазы тесно связаны с концентрациями минерального и органического фосфора и процессами первичного продуцирования. Фосфатазная активность возрастает, как только концентрации минерального фосфора становятся лимитирующими для первичного продуцирования [Fitzgerald, Nelson, 1966; Paasche, Erga, 1988]. Поэтому самые высокие активности фосфатазы мы наблюдали в тех районах, где концентрации фосфатов были ниже 0,1 мкMP при интенсивном первичном продуцировании. Можно предположить, что высокие продукция и биомасса фитопланктона в этих районах (Мордасова; Налетова и др., наст.сб.) при столь низком содержании фосфатов образуются в основном за счет рециклинга фосфора. По нашим данным, в фотическом слое Охотского моря, где концентрации фосфатов были близки к аналитическому нулю, а концентрации органического фосфора - довольно высокими (0,7 - 0,9 мкMP), первичная продукция, рассчитанная поскорости минерализации фосфатов (т.е. на рециклинге), составила 10 - 12 мг С/(м* - ч), что соответствовало данным по первичной продукции, полученным кислородным методом (Налетова и др., наст. сб.). Тесная взаимосвязь между активностью фосфатазы и уровнем минерального фосфора наблюдалась и в океане (Venkateswaran, Natarajan,1984], и в морях (Агатова, Лапина, 1994; Ильин, 1993; Nyman, Graneli, 1983], и в озерах (Berman, 1970; Wynne,1977). Однако, если популяция фитопланктона находится в физиологически неактивном состоянии, то концентрации минерального фосфора не определяют величину активности фосфатазы. Например, в центральной части моря, где цветение фитопланктона уже прошло (низкая продукция, минимальные концентрации хлорофилла, взвешенных углеводов и белка) и концентрации минерального фосфора не превышают 0,23 мкМ Р, а сообществу фитопланктона не требуется быстрой регенерации фосфатов, скорости минерализации фосфора в фотическом слое порядка 0,005 мкМ Р/(л в ч).
Высокие скорости расщепления фосфорорганических соединений могут быть обусловлены не только недостатком фосфатов для создания первичной продукции, но и особенностями метаболизма данной популяции микропланктона. Например, на мелководье вдоль западного берега Камчатки и на входе в залив Шелихова высокие скорости минерализации фосфора (общая активность фосфатазы в среднем составила 0,010 - 0,012 мкМ Р/(л - ч) были определены при довольно высоких концентрациях минерального фосфора (более 0,4 мкМ Р). Здесь было скопление микропланктона, активно расщепляющего фосфорорганические соединения, о чем свидетельствуют высокие концентрации взвешенных углеводов и белка и довольно большая удельная активность фосфатазы.
Неравномерное вертикальное распределение интенсивности процессов регенерации фосфатов обусловлено различными причинами. Так, в фотическом слое оно связано в основном с интенсивностью процессов первичного продуцирования: при уменьшении фосфатов в подповерхностных горизонтах, где фиксируется максимум продукции фосфатазная активность увеличивается; но как только содержание минерального фосфора начинает расти, активностъ фосфатазы падает (см. рис.4). На шельфе, где происходит равномерное увеличение минерального фосфора ко дну, уменьшается и общая и удельная активность фосфатазы (см. рис.4,б). В пелагиали появление вторичного максимума активности фосфатазы, особенно удельной, на границе ТПС и ХПС, как правило, обусловлено повышением концентраций органического фосфора. Здесь наиболее четко проявляется свойство индуцибельности ферментов щелочной фосфатазы, т.е. количество субстрата определяет количество фермента [Siuda, Gude, 1994].
По изменению активности щелочной фосфатазы тоже можно проследить распространение распресненных вод в Сахалинском заливе. Здесь при создании биогидрохимического барьера в зоне смешения речных и морских вод также происходит увеличение в 2-3 раза активности фосфатазы в популяции микропланктона, как и активности ферментов ЭTC.
Низкие величины энергии активации, полученные для ферментов ЭТС и щелочной фосфатазы у микро- и зоопланктона, позволяют им в холодных водах поддерживать активный метабоPAJE3M, IO, HTeHCMB HOCTH равный таковому OõTTaiTe Wei TeT LWENIX вод Интересно, что увеличение температуры воды в фотическом слое летом 1994 г. в 1,5-2 раза по сравнению с тем же периодом 1993 г. (Богданов, наст.сб.) привело к значительному повышению энергии активации как ферментов ЭTC, так и ферментов щелочной фосфатазы только во фракции микропланктона. Это указывает на способность последнего к быстрой перестройке метаболизма в ответ на изменения условий окружающей среды. Позтому в его популяции в Охотском море преобладают мезофильные организмы над психрофильными.
Сравнивая время регенерации фосфатов и СО, в экосистемах шельфа и пелагиали Охотского моря, следует отметить, что несмотря на значительную разницу времени оборота фосфора и углерода (болыше, чем на порядок), минимальные величины этих показателей характерны для фотического слоя высокопродуктивных вод. Однако при интенсификации деструкционных процессов во всей толщевод на шельфе и в глубинных слоях время оборота как фосфора, так и углерода может значительно уменьшаться (см.табл.1).
В ПМС активизируются биохимические процессы, катализируемые ферментами различных классов. Механизм активирования этих процессов неодинаков в разных районах. В ряде случаев активностъ ферментов ЭТС и фосфатазы увеличивается в основном за счет концентрирования гетеротрофного микропланктона, так как концентрация белка в этом слое также увеличивается в 3 - 10 раз (Агатова и др., наст.сб.); при этом удельная активность изменяется незначительно, а ее величины в ПМС даже ниже, чем в подстилающем слое. Иногда увеличение активности происходит за счет активирования того или иного фермента. На это указывает значительное увеличение удельной активности исследованных ферментов в ПМС по сравнению с нижележащим слоем. Низкие значения времени оборота углерода и фосфора в продукционно-деструкционном цикле в ПМС могут свидетельствовать об активном участии микроорганизмов в обмене веществом и энергией между гидросферой и атмосферой. Аналогичные данные по увеличению активHO"" ဖ္ရစ္သဖ္ရcHron ЭТС и фосфатазы были получены нами для ПМС Берингова моря (Агатова, ЛаIllHH
Выводы
1. Активность ферментов ЭТС максимальна на шельфе Камчатки и Сахалина, а также в слое максимальных градиентов кислорода в глубоководных районах моря.
2. Для зон активного первичного продуцирования характерны высокие скорости регенерации фосфатов из фосфорорганических соединений. Концентрация фосфатов около 0,2 мкМ является пороговой, ниже которой наблюдается обратная корреляция между активностью фосфатазы и содержанием фосфатов. При низких концентрациях фосфатов до 80% первичной продукции может создаваться за счет их рециклинга.
3. Время оборота фосфатов и углерода минимальное в фотическом слоевод при интенсивном первичном продуцировании. При значительных скоростях деструкционных процессов время оборота фосфатов в глубинных слоях может достигать значений, характерных для фотического слоя.
4. Температурные зависимости скоростей потребления кислорода и гидролитического расщепления фосфорорганических соединений микропланктона и зоопланктона в водах Охотского моря не подчиняются закону Вант-Гоффа в области температур 1 - 19°С. Для этих реакций здесь характерны низкие значения энергий активации (3 - 6 ккал/моль), что позволяет обитателям холодных вод поддерживать активный метаболизм.
5. Микрогетеротрофы способны быстро реагировать на изменение температуры окружающей среды, изменяя энергии активации реакций, катализируемых ферментами ЭТС и щелочной фосфатазы.
6. Создание биогидрохимического барьера при смешении речных и морских вод в Сахалинском заливе выражается в увеличении в зоне смешения активности ферментов и ЭТС и щелочной фосфатазы.
7. Впервые для Охотского моря определены активности ферментов ЭТС и щелочной фосфатазы в поверхностном микрослое. Активность этих ферментов здесь в 3 - 10 раз выше, чем в нижележащем слое, а время рециклинга углерода и фосфора в продукционно-деструкционном цикле
A.M. Aгатова
Смотрите также