Биологическая структура популяций кеты
Возрастной состав
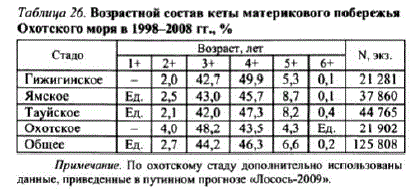
Кета, воспроизводящаяся в реках побережья, возвращается на нерест в основном в возрасте 2+.5+ лет (табл. 26).
Таблица 2б. Возрастной составкеты материкового побережья
Примечание. По охотскому стаду дополнительно использованы данные, приведенные в путинном прогнозе «Лосось-2009»,
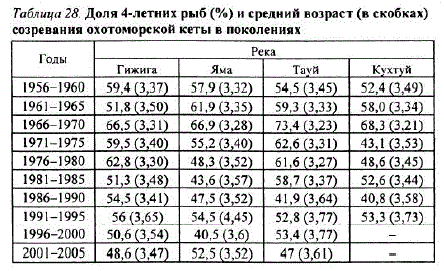
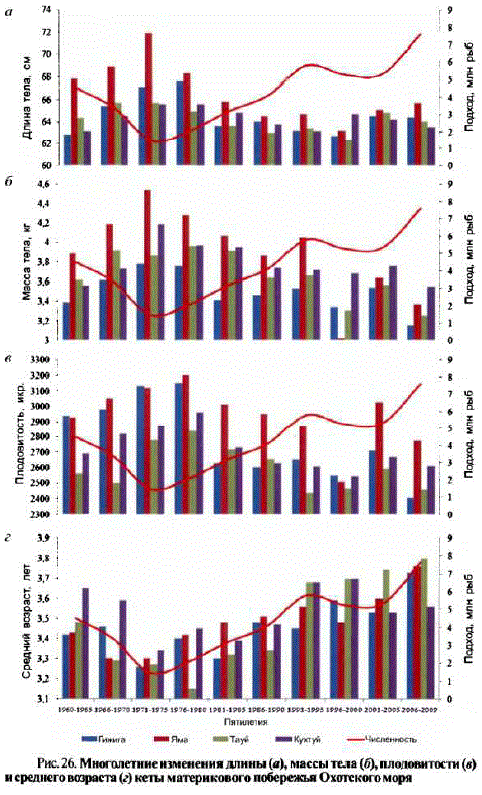
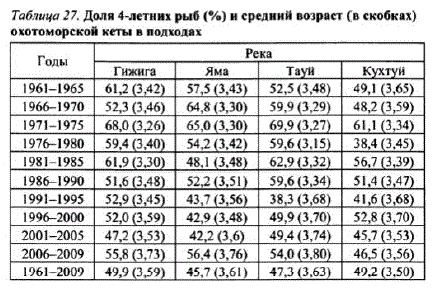
За прошедший период средний возраст кеты в подходах несколько снизился в 1970—1980-е и повысился в 1990-е гг. Сходная картина прослеживается при оценке среднего возраста созревания кеты в подходах и поколениях (табл. 27, 28). По-видимому, это обусловлено наблюдаемым во второй половине 1990-х гг. замедлением созревания поколений и возвратом значительной частикеты в возрасте 4+.5+ лет (вместо обычных 3+.4+ лет), которые составляли в среднем до 82—92% численности подходов в 1995—1996 гг.
Таблица 27. Доля 4-летних рыб (%) и средний возраст (в скобках) охотоморской кеты в подходах
При изучении возраста созревания в поколениях кеты установлено, что большая часть рыб (52,0—58,9%) созревает и возвращается на нерест в 4-летнем возрасте. Тенденция к преобладанию их в поколениях наблюдается и при разбивке рассматриваемого временного отрезка по пятилетиям (см. табл. 28).
При рассмотрении динамики возрастного состава в течение анадромной миграции следует отметить, что в начале нерестового хода преобладают рыбы
старшевозрастных групп — 6+.4+ лет, к середине хода их доля снижается, появляются, а затем начинают составлять большинство 4-летние рыбы (3+).
Таблица 28. Доля 4-летних рыб (%) и средний возраст (в скобках) созревания охотоморской кеты в поколениях
В конце нерестовой миграции в уловах появляются 3-летние особи (2+). Как правило, в зависимости от выживаемости и численности формирующихся поколений в подходах доминируют рыбы двух возрастных групп — 3+ и 4+ лет
Длина и масса тела кеты
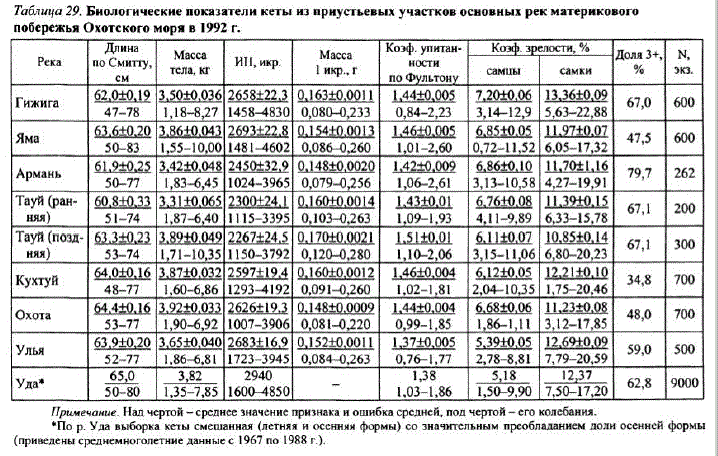
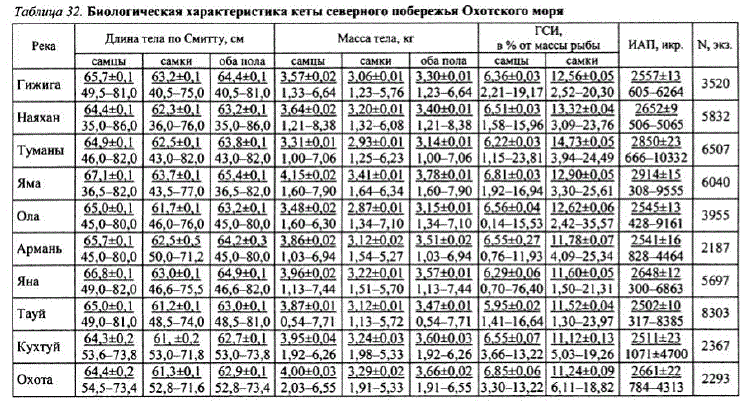
У кеты охотоморского побережья самцы, как правило, крупнее самок. Минимальная длина охотоморской кеты 47,0 см, максимальная — 83 см, масса тела, соответственно, 1,18 и 10,35 кг (табл. 29).
При сравнении средних показателей длины и массы тела кеты основных популяций побережья за один и тот же год (1992) несколько более крупная кета отмечена в реках юго-западного участка побережья (pp. Охота, Кухтуй). На северовостоке района наибольшей длиной и массой тела выделяется кета р. Яма. Средние показатели длины и массы уменьшаются от начала к концу нерестового хода за счет увеличения в подходах доли более мелких младшевозрастных рыб (2+). Кета ранней формы отличается от поздней по срокам нерестового хода и ряду биологических показателей, в том числе подлине и массе тела (см. табл. 29).
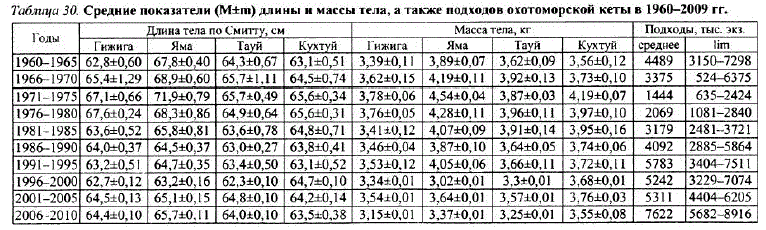
В 1936—1939 гг. отмечен пик вылова лососей в северной Пацифике. Затем в период депрессии 1960—1970-х гг. численность тихоокеанских лососей снизилась более чем в 3 раза по отношению к уровню запасов 1930-х гг. При рассмотрении изменений среднемноголетних показателей длины и массы тела можно отметить их некоторое увеличение в период депрессии в конце 1960-х — начале 1970-х гг., что, видимо, связано с общим снижением численности азиатских стад лососей и улучшением пищевой обеспеченности в местах основного нагула в океане (табл. 30). Биомасса только одного вида — кеты — достигала 500—600 тыс. т, при этом ее доля составляла 47% общей массы всех шести BhuoB JIococea (Neave, 1961; Salo, 1991).
Очередной подъем численности стад лососей всех стран Тихоокеанского Кольца произошел в начале 1980-х гг. Этому способствовали как благоприятная океанологическая обстановка в районах нагула, так и интенсификация искусственного воспроизводства лососей странами Тихоокеанского бассейна, в результате чего продукция заводской молоди достигла 5,5 млрд шт. (Heard, 1998).
В связи с этим наиболее впечатляют успехи Японии в области заводского разведения кеты: уровень ее прибрежного вылова с 12—20 тыс. т в 1960-е гг.
увеличился до 200—250 тыс. т в 1990-е гг. (Hiroi, 1998). В результате общий вылов лососей Россией, Японией, Канадой и США в 1995 г. достиг 962 тыс. т, из них около 36% cocTaBJIH JIa Kerra (Statistical..., 1996; Klyashtorin, Rukhlov, 1998; Noakes et al., 1998).
По отношению к периоду депрессии 1960—1970-х гг. запасы лососей увеличились более чем в 3 раза, что, по-видимому, привело к изменениям внутривидовой и биологической структуры стад. Заметно (с 6 до 48%) увеличилась численность кеты ранней формы (Волобуев, Голованов, 2001). Ранняя кета отличается от поздней меньшими размерами, массой тела, упитанностью и массой икринок (данные табл. 28—30 хорошо иллюстрируют это). В частности, произошло увеличение среднего возраста созревания и уменьшение длины, массы тела и плодовитости охотоморской кеты в 1980—1990-е гг., что, очевидно, может Kbcвенно свидетельствовать о росте напряженности внутри- и межвидовых пищевых отношений лососей в экосистеме северозападной Пацифики (Волобуев, Волобуев, 2000; Wolobuev, 2000).
В 1990-е гг. отмечены изменения биологической структуры кеты охотоморских стад. Так, масса североохотоморской кеты в среднем снизилась на 0,3—0,4 кг, а длина — на 3—4 см (рис. 26 хорошо иллюстрирует это). Прослеживается увеличение размеров, массы тела, плодовитости и уменьшение возраста созревания в период снижения численHocTH ToxoloB B 1970-e TT: B 1980-1990-e TT, напротив, с увеличением численности стад первые три показателя снизились, а возраст созревания увеличился. При рассмотрении среднемноголетних показателей длины и LLLLLL LLLLLaL LLLL LLLEL KaLGLLGG S Laaa0LLL LLL лет отмечено, что кета четных лет в среднем крупнее кеты генераций нечетных лет: Ha 0,5-1, 1 cM HI 0,07–0,20 Kr (BoJIo6yeB, Boлобуев, 2000).
Особенно значительное снижение длины и массы тела рыб по отношению к среднеMHOTOJeTHM OKa3aTJAM OTMeeHO J1A поколений анадырской кеты 1987—1990 гг.: в подходах 1992—1994 гг. средняя масса рыб уменьшилась на 0,8—0,9 кг, длина — на 4—5 см.
Снижение размеров, массы тела и увеличение возраста созревания анадырской кеты, по мнению некоторых авторов (Чигиринский, 1994: Путивкин, 1999), объясняется увеличением общей численностилососей в океане наместах основного нагула, в том числе в Беринговом море, за счет роста численности североамериканских и японских стад,
Сходные трансформации биологической структуры в этот же период отмечены и для лососей североамериканского и японского происхождения: уменьшение размеров и массы тела и увеличение возраста созревания (Ishida et al., 1993; Ricker, 1995; Bigler etal, 1996, Helle, Hoffman, 1995, 1998; Kaeriyama, 1996), При анализе основных биологических характеристик охотоморской кеты за разные годы отмечено уменьшение ее качественных показателей впоследнее десятилетие, что, очевидно, является следствием роста численности стад азиатских и североамериканских лососей и обострения напряженности межвидовых пищевых связей. Вероятно, энергоемкость экосистемы северной Пацифики в настоящее время обеспечивает близкий к предельно допустимому уровень продукции биомассы лососей. Возможно, дальнейшее искусственное наращивание численности тихоокеанских лососей может привести к еще большей трансформации биологической структуры стад, ухудшению их качественных характеристик, снижению товарной ценности уловов.
По-видимому, биомасса лососей, которая может поддерживаться экосистемой в этих условиях, попадает под определение «максимальной поддерживающей емкости среды» (Одум, 1986).
В настоящее время в развитии экосистемы северной Пацифики мы наблюдаем значительное аллогенное влияние, обусловленное антропогенным вмешательством. Взаимодействие ауто- и аллогенных процессов, вероятно, оказало воздействие на траекторию развития сукцессии северотихоокеанской экосистемы, что нашло отражение в изменении биологической структуры стадазиатских и североамериканских лососей.
Известно о влиянии плотностно-зависимых факторов прискате в морское прибрежье многочисленных поколений горбуши (Андриевская, 1998). В этих случаях происходит обострение пищевых межвидовых отношений междугорбушей и кетой (Карпенко, 1981, 1983, 1998; Шершнева, Коваль, 2004), когда кета вынужденно переходит напитание второстепенными низкокалорийными объектами питания. Это отражается на темпе роста, скорости созревания и возрасте возврата на нерест. Многочисленные поколения горбуши могут влиять на пищевые отношения между кетой и неркой (Ерохин, 1998). Существует мнение, ми горбуши нечетных лет за счет высокой степени пищевого сходства, как это было отмечено В.Л. Костаревым (1964a). Как известно, между кетой и горбушей отмечается высокое пищевое сходство: СП-коэффициенты достигают 70— 90% (Карпенко, 1998; Ефимкин, 2003; Кловач, 2003; Старовойтов, 2003). Четко обозначенные изменения возраста созревания, длины и массы тела, выживаемости в море и возвратов кеты могут быть обусловлены влиянием параллельных поколений горбуши и действием плотностно-зависимых факторов как в пресноводный (конкуренция за места размножения, перекопка нерестовых гнезд, изменение поведенческих реакций и др. (Смирнов А.Г., 1947; Ловецкая, 1948, Бирман, 1956; Костарев, 1964a, Todd, 1966; Pratt, 1974), так и в морской (пищевая конкуренция) периоды жизни (Андриевская, 1958, 1966; Бирман, 1960, Иванков, Шершнев, 1968; Карпенко, 1998; Коваль, 2009). В результате межвидового взаимодействия происходит частичное перекрывание адаптивных зон и конкурентное подавление одного вида (кета) другим (горбуша).
Ухудшение биологических показателей кеты в годы высокой численности горбуши можно рассматривать как результат действия «принципа конкурентноto McKJIo'eHHA). Tay3e (Tayse, 1934; Hardin, 1960; Gallagher, 1979).
В целом приведенные оценки параметров биологических показателей охотоморской кеты не выходят за характерные для вида пределы. Отмечена мозаичность в изменчивости качественных показателей кеты, отсутствие выраженной клины, что, возможно, является результатом анализа частично смешанных выборок двух сезонных форм в юго-западной части ареала (pp. Кухтуй, Охота, Улья, Уда).
Экологическая и биологическая неоднородность кеты по ареалу обусловлена разнообразием условий воспроизводства, стартовых условий в постэмбриогенезе, различиями гидрологического и гидробиологического фона прибрежья, продолжительностью и условиями нагула в океане и т. д.
При рассмотрении размерно-весовых показателей кеты материкового побережья Охотского моря следует отметить, что, как и в 1970-е гг. (Клоков, 1970, 1973б), в настоящее время наибольшими длиной и массой тела выделяется кета р. Яма (см. табл. 29, 30). Столь устойчивый во времени феномен объясняется, на наш взгляд, следующими обстоятельствами. Река Яма имеет большой мелководный лиман, скатываясь в который молодь проходит период адаптации и этап эстуарного нагула. После выхода из лимана в прибрежье она попадает в район высокой кормности, что обеспечиваетей более благоприятные стартовые условия по сравнению с кетой других популяций. Район прибрежья Ямской губы и Ямских островов является зоной апвеллинга с высокой продуктивностью зоопланктона в теплое время года, биомасса которого достигает 1000 мг/м" (Маркина, Чернявский, 1984).
Соотношение полов кеты
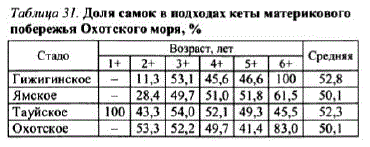
Соотношение полову охотоморской кеты неодинаково в различных возрастных группах. У молодых рыб в возрасте 2+, как правило, преобладают самцы, у 6—7-леток — самки (табл. 31). В наиболее массовых возрастных группах 3+ и 4 + соотношение полов близкое к равному. В среднем
Таблица 31. Доля самок в подходахкеты материкового побережья Охотского моря, %
ромной миграции. В начале нерестового хода преобладают самцы — до 65—70%, к середине его соотношение самцов и самок выравнивается, а к концу миграции начинают доминировать самки — до 60—65%.
4.10.4. Плодовитость
Абсолютная плодовитость охотоморской кеты коррелирует с длиной тела (Клоков, 1975). Пределы варьирования плодовитости кеты основных популяций составили 300—10332 икр., средние величины были в пределах 2502—2914 икр, (табл. 32).
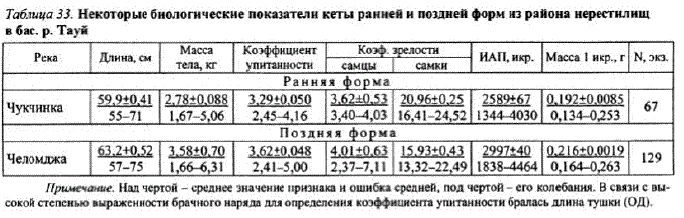
Кета ранней формы имеет большую плодовитость по сравнению с одноразмерными особями поздней кеты, что обусловлено меньшими размерами икринок (табл. 33) (Медников и др., 1988; Волобуев и др., 1990). Размер икринок зависит от стадии их развития. Показано, что кета, размножающаяся в реках большей протяженности, имеет в устье менее зрелую, более мелкую икру, и, наоборот, в малые реки она подходит с более крупной зрелой икрой. При сравнении массы икринок кеты ранней и поздней форм из приустьевых участковр. Тауй (см. табл. 29) и с нерестилищ этой же реки (см. табл. 33) отмечено увеличение их средней массы: у первой формы — на 20%, у второй - на 27%.
В настоящее время абсолютная плодовитость охотоморской поздней кеты близка к TaKoBon 1970-x TT. (KJIoKoB, l975), a nLJIoJIoBMтость ранней формы сходна с плодовитостью летней амурской и западнокамчатской кеты (Николаева, 1974; Платошина, 1984). Наибольшая среднемноголетняя величина плодовитости отмеченаукеты р. Яма — 2914 икр, затем идет кета рр. Туманы, Охота, Гижига (см. табл. 32). При рассмотрении среднемноголетних показателей плодовитости североохотоморской кеты в ряду рек Гижига — Кухтуй можно отметить, что в целому кеты северных популяций она выше. Сходная закономерность наблюдается усимы и камчатской кеты (Иванков, 1968, Николаева, 1972, 1974).
4.10.5. Упитанность, зрелость
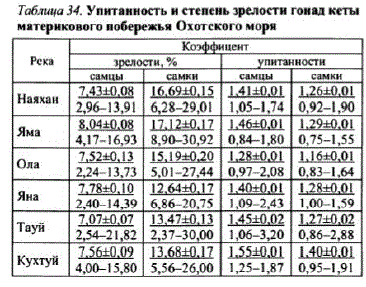
Средний коэффициентупитанностикеты всех популяций снижается от начала к концу хода с 1,80—1,42 до 1,66—1,30%, что, видимо, объясняется увеличением доли самок и самцов младших возрастных групп к концу нерестовой миграции.
В течение сезона упитанность колебалась от 0,76 до 2,61 (см. табл. 29). Изучение этого признака за ряд лет показало, что он может колебаться в более широких пределах — от 0,75 до 3,20 (табл. 34). Максимальной упитанностью выделяется поздняя кета рр. Яма,
Тауй, Кухтуй. У рыб юго-западной части побережья (pp. Улья, Уда) упитанность снижается (см. табл. 29). Обычно упитанность самцов выше. В устье рек разница в коэффициентах упитанности между самцами и самками составляет 0,05—0,08%, на нерестилищах эти различия возрастают на порядок — до 0,6—0,8%.
Упитанность охотоморской кеты близкак таковой восточнокамчатской (Ни
колаева, 1974) и согласуется с данными В.Л. Костарева (1967) для кеты Охотского
I
района. Кета ранней и поздней форм различа
Таблица 34. Упитанность и степень зрелостигонад кеты материкового побережья Охотского моря
эффициент зрелости самцов ранней кеты снижается до 3,62, поздней — до 4,01% вследствие превращения генеративной ткани семенников в половые продукты, а коэффициент зрелости самок возрастает в среднем до 16—21% из-за увеличения размера и массы икринок (см. табл. 33). Массагонадотдельных самок на нерестилищах достигает 1200 г.
Морфометрическая характеристика кеты
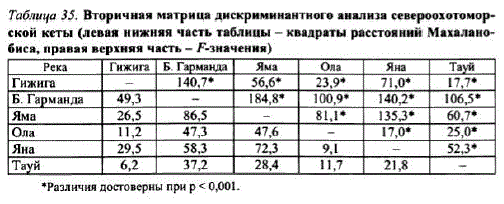
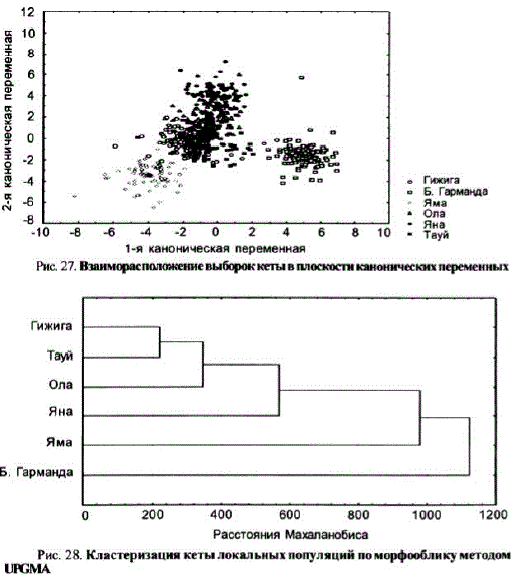
Географическая изменчивость морфооблика. Локальные популяции ксты, воспроизводящейся в реках материкового побережья Охотского моря, четко различаются поморфометрическим признакам. При исследованиях кеты pр. Гижига, Б. Гарманда (гижигинское стадо), Яма (ямское стадо), Ола, Яна и Тауй (тауйское стадо) в дискриминантную модель с пошаговым включением переменных вошли 22 из 24 признаков. На плоскости главных канонических переменных выборки кеты образуют единое поле, однако каждая из них занимает отдельный его сектор (рис. 27). Примечательно, что географически удаленные популяции (например, кета рр. Гижига и Ола, Гижига и Тауй) располагались на наименьшем удалении друг от друга (рис. 28, табл. 35).
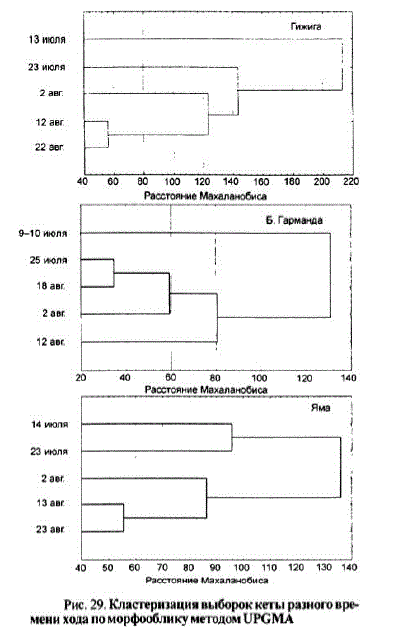
Темпоральная изменчивость морфооблика кеты просматривается на протяжении ее нерестовой миграции. Например, у кеты рр. Гижига, Б. Гарманда и Яма выборки формируют два разновеликих кластера, включающих в себя от 1 до 4 выборок (рис. 29).
Кластерный анализ относится к методам разведки данных, поэтому для проверки наличия темпоральных группировоки проверки степени различий между ними поморфометрическим признакам был проведен дискриминантный анализспошаговым включением переменных, который показал, что в результате приспособления кеты к условиям воспроизводства у разных темпоральных групп, различающихся местами нереста, появились различия поряду признаков внешней морфологии.
Кетар. Гижига. В дискриминантную модель вошли 14 из 24 признаков. Дискриминантная функция обнаруживает прямую корреляцию свысотой спинного плавника и отрицательную взаимосвязь с горизонтальным диаметром глаза.
Кета разных сроков хода достоверно различается поморфологическому облику: центроиды выборок располагаются на расстоянии 14,4 D: (F = 17.7, р < 0,001) друг от дpуга.
Таблица 35. Вторичная матрица дискриминантного анализа североохотоморской кеты (левая нижняя часть таблицы — квадраты расстояний Махаланобиса, правая верхняя часть — F-значения)
Рис. 29, Кластеризация выборок кеты разного времени хода поморфoобликуметодом UPGМА
Кета р. Б. Гарманда. В дискриминантную модель вошли 13 из 24 признаков. Дискриминирующая функция обнаруживает наиболее тесную связь с признаками длина хвостового стебля, диаметр глаза, ширина лба, ширина верхнечелюстной кости и длина брюшных плавников. Гипотеза о совпадении центроидов выборок, принадлежащих кете разных сроков хода, не подтверждается, несмотря на то что центроиды выборок лежат сравнительно близко — 9,2 D3, F-значения ир-уровни свидетельствуют о достоверности различий кеты ранней и поздней форм поморфологическому облику (F = 12,3, p < 0,001).
Кетар. Яма. В дискриминантную модель вошли 13 из 24 признаков. Наиболее значимыми для разграничения экологических форм являются следующие
признаки: диаметр глаза, высота головы у затылка и антеанальное расстояние Центроиды выборок располагаются на статистически достоверном удалении друг от друга — 8,9 D;, (F= 16,1, p< 0,001).
Смотрите также