Развитие и рост камчатского краба в мальковый период
Как и на предшествующих личиночных стадиях, увеличение размеров тела мальков происходит за счетлиньки — сбрасывания хитинового покрова (рис. 6.3). Перед линькой старый панцирь истончается и деминерализуется. В момент линьки старый панцирь разрывается на границе головогруди и абдомена, и малек в новом мягкомпанцире выбирается наружу; размеры тела малька резко увеличиваются за счет осмотического поглощения воды и растяжения еще не затвердевших покровов тела (рис. 6.4).
Рис. 6.З. Линька малька
Рис. 6.4. Увеличение размеров Тела Малька После Линьки
В послелиночный период происходит интенсивный рост тканей и быстрое отложение хитина и минеральных солей в новом панцире, за счет чего панцирь приобретает механическую прочность.
В табл. 6.1 и на рис. 6.5 приведены наши данные по росту мальков, содержавшихся в условиях замкнутого цикла обеспечения при термостатировании на уровне 10—11 C, солености 32—35%о, наличии субстрата и кормлении мясом морских гидробионтов (преимущественно кальмара и мидии).
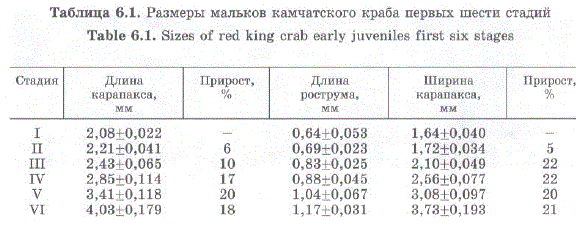
Таблица 6.1. Размеры мальков камчатского краба первых шести стадий
Продолжительность первой мальковой стадии составила в среднем 24 дня (260 градусо-дней) (минимум 18 суток — максимум 32 суток). Продолжительность второй и третьей стадий составили в среднем 29 суток (314 градусо-дней) и 30 суток (324 градусо-дня) соответственно (Борисов и др., 2004; Борисов, Ковачева, 2005в; Ковачева и др., 2005; Epelbaum et al., 2006). В дальнейшем при выращивании мальковасинхронность линьки значительно увеличивалась и продолжительность стадий варьировала от 40 до 50 суток (420—525 градусо-дней).
В условиях нашего эксперимента, рост мальков значительно превышал рост, наблюдаемый в природной среде (рис. 6.5).
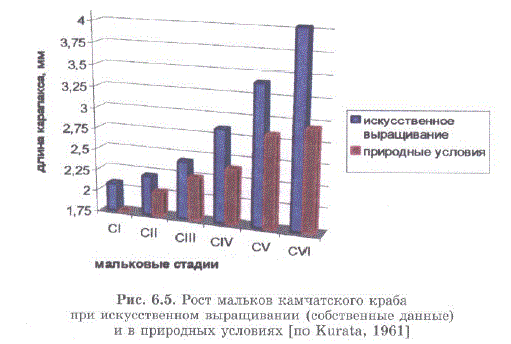
Рис. 6.5. PocT MajIEEcoB KaNIIaTCKoro Kpaoa при искусственном выращивании (собственные данные) и в природных условиях (по Kurata, 1961)
Fig. 6.5. Growth of red king crab juveniles rearing in artificial conditions (own data) and in nature according to Kurata, 1961)
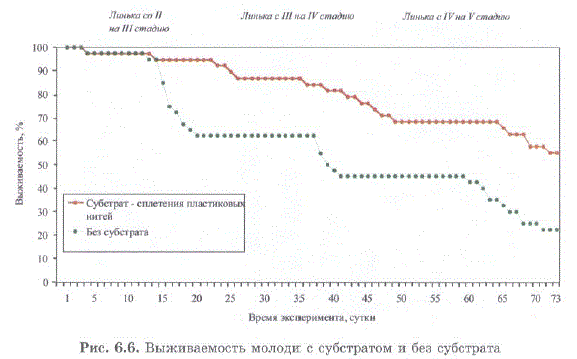
Во втором варианте этого же опыта отсутствовал субстрат при сохранении всех прочих условий (температура, соленость, корма). При отсутствии субстрата, выживаемость молоди за 73 дня наблюдений была более чем в 2 раза ниже по сравнению с особями, имевшими субстрат (рис. 6.6) (Кряхова и др., 2006; Kovatcheva et al., 2006a).
С целью получения данных по совокупному влиянию на развитие молодикамчатского крабатемпературы, состава кормов и наличия субстратанами был поставлен продолжительный эксперимент — 130 суток, схема которого приведена в табл. 6.2 (Кряхова и др., 2006; Koвачева, 2006а.
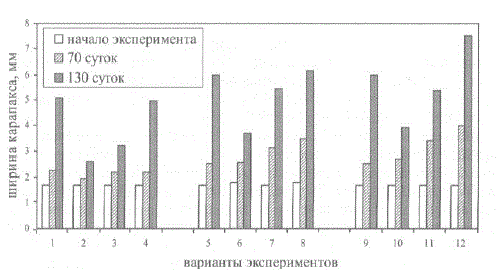
Наибольший прирост ширины карапакса отмечен при температуре воды 10 и 13 С (рис. 6.7). При 13С рост мальков был максимальным (средняя длина составила 7,5 мм, рис. 6.7, вар. 12). Но при отсутствии укрытий резко возрастала интенсивность каннибализма, в результате чего выживаемость мальков за 130 суток составила 7% (рис. 6.8, вариант 12). Понижение температуры воды с 10 С до 7 С вызывало значительное удлинение межлиночных периодов и уменьшение среднесуточного прироста в 2,2 раза (см. рис. 6.7, варианты 3, 7).
Рис. 6.6. Выживаемость молоди с субстратом и без субстрата
Fig. 6.6. Survival rate of juveniles with substrate (orange line) and without substrate (green line)
Таблица 6.2. Схема эксперимента по влиянию температуры, наличия субстрата и различных кормов на развитие мальков камчатского краба
Примечание: "w.m. — комбикорм «Wafer Mix» производства фирмы Tetra, гб. — корм из измельченных морских гидробионтов, тр. — влажный комбикорм на основе мяса трески. Legend: " W.m. – mixed fodder Wafer Mixo (Tetra Company), I6. - crushed marine hydrobionts food, Tp. - wet mixed fodder on basis of cod meat.
Рис. 6.7. Изменения ширины карапакса мальков. Примечание: в вариантах 1—4 температура 7 C; в вариантах 5—8 — 10 С; в вариантах 9—12 — 13 С; в вариантах 1—3, 5—7, 9—11 есть субстрат, в остальных — нет; в вариантах 1, 5, 9 использован влажный комбикорм на основе мяса трески; в вариантах 2, 6, 10 — комбикорм «Wafer Mix»; в вариантах 3, 4, 7, 8, 11, 12 — корм из измельченных морских гидробионтов
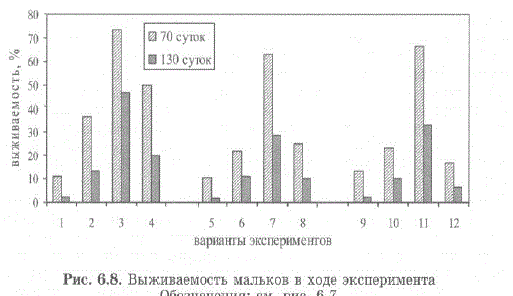
Влияние субстрата из спутанных пластиковых нитей было протестировано при всех трех температурах воды только при использовании естественного корма (Кряхова и др., 2006; Kovatcheva et al., 2006). Отсутствие укрытий снижало к 130 суткам эксперимента выживаемость мальков в 2,35; 2,90 и 4,71 раз при температуре 7, 10 и 13 C, cooTBeTcTBeHHo (cM. pMc. 6.8).
Использованный нами субстрат хорошо зарекомендовал себя при проведении работ с молодью речного рака и молодью гигантской пресноводной креветки (Лебедев и др., 2004; Жигин и др., 2004; Борисов, Тертицкая, 2005; Тертицкая, Ковачева, 2005; Тертицкая и др., 2006a). В целом, положительное влияние убежищ и различных субстратов, имитирующих водные растения, на выживаемость характерно для большинства видов декапод [Nair et al., 1999; Figler et al., 1999; Soderback, 1994). Использование структурирующих объем субстратов позволяет распределяться особям не только по дну, но и по всему объему емкости, что значительно снижает вероятность встречи особей и, как следствие, уменьшает каннибализм. Следовательно, наличие укрытий является обязательным условием успешного культивирования молоди камчатского краба. В этой связи, в дальнейшем обсуждаются только варианты эксперимента с укрытиями.
Выживаемость при использовании натуральных кормов (варианты 3, 7, 11) была выше, чем при использовании комбикормов (варианты 1, 2, 5, 6, 9, 10) (см. рис. 6.8). Основными причинами гибели были каннибализм или сочетание нарушений линьки и каннибализма. Видимо, состав комбикормов полностью не удовлетворял пищевые потребности мальков, что компенсировалось усилением каннибализма. Взаимосвязь интенсивности каннибализма камчатского краба и других видов декапод и состава кормов при их искусственном выращивании была продемонстрирована в ряде исследований [Ling, Merican, 1961; Lykep314c M IIp., 1977; Brodersen et al., 1989; Mortensen, Damsgard, 1996; Barki et al., 1997]. При тестировании 5 видов корма (сухой лососевый гранулированный корм, влажные гранулы из мяса лосося и калянусов, сухой тресковый корм, сырое мясо креветки, отходы креветочного производства), в 90% случаев мальки камчатского краба предпочитали 2 последних. Но даже при питании кормами из креветки, смертность молоди была очень высокой (Mortensen, Damsgard, 1996].
В наших экспериментах при низкой температуре (7 С) смертность снижалась, что, по-видимому, связано с сокращением количества линек, прошедших у мальков при этой температуре за экспериментальный период, и, следовательно, уменьшении каннибализма. В то же время, при самой низкой из исследованных нами температур, рост был существенно замедлен, что является значимым отрицательным результатом при разработке биотехники культивирования. Следовательно, при выращивании молоди температурный диапазон от 10 до 13 С предпочтительнее (Кряхова и др., 2006; Ковачева, 2006a).
Увеличение выживаемости при низких температурах отмечено и IpyTIMM aBTopaMII Rice, Brodersen, 1985; Ka3aeB, 1995). TaK, IO IaHным С. Райс и Х. Бродерсен (1985) выживаемость молоди камчатского краба была выше при температуре воды 5 С по сравнению с выживаемостью при температуре 10, 15 и 20 С. Авторы, также как и мы, связывают это с сокращением количества линек при низкой температуре. При этом, С. Райс и Х. Бродерсен (1985) на основании сопоставления скорости роста и выживаемости при разных терморежимах культивирования, пришли к выводу, что оптимальной для мальков является температура 10 С, при которой продолжительность межлиночного периода на 50% короче, чем при 5 С, а выживаемость почти одинаковая (около 65% за 90 дней). При 15 и 20 Счастоталинек возрастает, но за счет каннибализма резко падает выживаемость. По этой причине, в аномально теплые годы возможно увеличение смертности молоди [Rice, Brodersen, 1985]. При температуре ниже 5 C или выше 19 С резко снижается количество потребляемой крабами пищи (Логвинович, 1998).
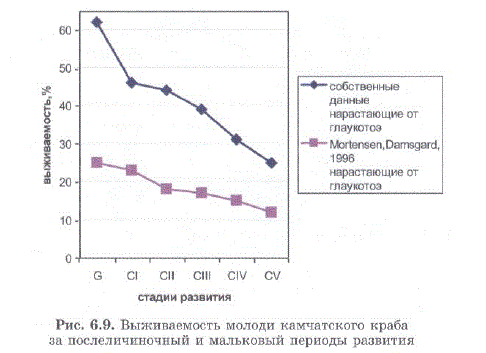
Наиболее детальные данные по выживаемости молоди камчатского краба при культивировании в температурных условиях, близких к оптимальным (8—10 С), приведены норвежскими учеными. Однако выживаемость у них в 2,07—2,48 раза хуже, полученной нами (рис. 6.9).
Данные по росту и продолжительности развития молодикамчатского краба в аквакультуре немногочисленны. В аквариальных условиях при повышении температуры от 0—2 до 11—12 С рост молоди
Рис. 6.9. Выживаемость молоди камчатского краба за послеличиночный и мальковый периоды развития
краба увеличивается в 2 раза. Причем, рост ускоряется за счет сокращения межлиночных периодов, а не увеличения прироста Ширины карапакса после линьки (Казаев, 1995).
IIo IaHHLIM A. MopTeHCeH M B. LaMcTop II IMortensen, Damsgard, 1996), с 45-го (C I) по 175-й день после оседания, средняя масса мальков краба при выращивании в искусственных условиях увеличилась с 4,3 до 138,5 мг, длина карапакса — с 1,8 до 5,9 мм. После 450 дней средняя масса крабов достигла 3,2 г при длине карапакса 17,1 мм (максимально до 8 г и 23 мм), среднесуточный прирост — 3% от массы тела краба в начале и около 1% в конце опыта (Mortensen, Damsgard, 1996; Дамсгорд, 2000). Полученные в Тромсё ростовые и размерные характеристики молоди краба несколько ниже, чем в природе, и уступают также американским данным по искусственному разведению камчатского краба на Аляске (Stevens, Munk, 1990). Норвежские исследователи находят объяснение этому факту в слабой изученности пищевых потребностей молоди краба и, как результат, недостаточном COOTBeTCTBIIII 3aaBaeMOTO MM KODMa.
Нами были исследованы продолжительность межлиночных периодов и рост старшевозрастной молоди (двух-трехлетней) камчатского краба, отловленной в районе Семи островов Баренцева моря в августе — сентябре. Молодь принадлежала к двум размерным группам: I с шириной карапакса 7—9 мм и II — 15—18 мм. Наблюдения проводили отдельно за каждой особью при температуре воды 10 C в продолжение 11 месяцев (Борисов, Ковачева, 2005) (рис. 6.10).
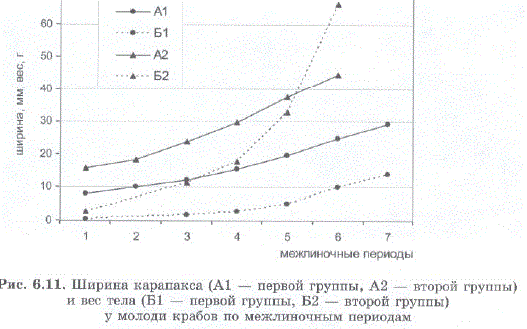
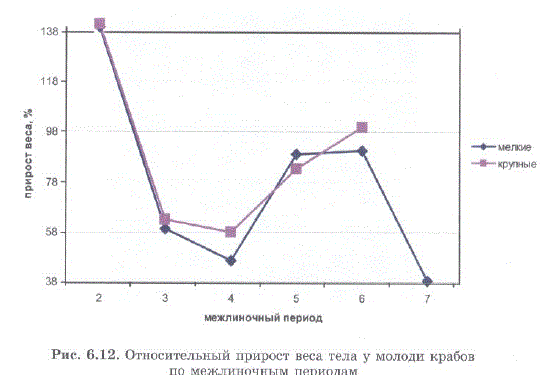
За 7 линек средний вес мальков из первой группы возрос от 0,5 до 14 г, из второй — от 2,9 до 66 г (рис. 6.11). При этом относительный прирост веса был приблизительно одинаков в группах мелких и крупных особей. Максимальный относительный прирост в обеих группах отмечен после первой линьки: 140% — для мелких крабов и 141% — для крупных; минимальный прирост после 3 и 6 линьки — 38,6—57,9% (рис. 6.12).
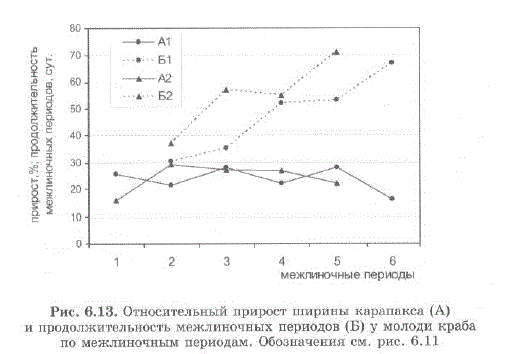
За 11 месяцев средняя длина мелких особей возросла до 29,3 мм, а крупных — до 44,5 мм. Максимальный индивидуальный линейный прирост за межлиночный период в первой группе составил 42%, во второй — 37%. Средние значения прироста за стадию изменялись для мелких особей в диапазоне от 16,0 до 28,2%, составляя в среднем для всех стадий 23,6%; для крупных особей — от 15,9 до 29,4% при среднем значении 24,3% (рис. 6.13). То есть, для исследованных нами размерных групп, относительный линейный рост существенно не зависел от начальной ширины карапакса.
Минимальный межлиночный период одной особи составил в первой группе 31 день, во второй — 36 суток. Средняя продолжительность межлиночного периода у мелких особей была короче, чем у крупных — 47,4 и 55 суток, соответственно.
Через шесть месяцев после начала эксперимента были отмечены случаи гибели крабов. Увеличение межлиночных периодов, смерт
Рис. 6.13. Относительный прирост ширины карапакса (A) и продолжительность межлиночных периодов (Б) у молоди краба по межлиночным периодам. Обозначения см. рис. 6.11
ность и снижение темпа весового роста могли быть следствием недостатка необходимых микроэлементов при содержании крабов в искусственной морской воде, а также отсутствия естественных кормов и зимней диапаузы.
При непродолжительном совместном содержании особей из разных размерных групп наблюдались случаи каннибализма, причем крупные мальки поедали более мелких даже в межлиночный период, т.е. когда у мелких особей были жесткие покровы. В то же время, при совместном содержании в течение 9 месяцев двух крупных мальков (ширина карапакса 15—18 мм) в аквариуме с площадью дна 0,4 м" они не нанесли повреждений друг другу. За период наблюдений линьки происходили почти синхронно. После рассинхронизации линек, произошедшей на 10-м месяце, крупный малек съел более мелкого.
Вестественных условиях мальки камчатского краба образуют достаточно плотные скопления, причем в течение первых трех лет на одной территории одновременно может обитать молодь трех возрастов. При этом возможны случаи каннибализма (Переладов, 2003). В работах по изучению питания мальков и молоди камчатского краба вестественной средена данный момент не упоминается ни одного случая обнаружения в желудках частей особей собственного вида. Однако такие свидетельства имеются для взрослых особей и реже — молоди краба-стригуна [Lovrich, Sainte-Marie, 1997].
Смотрите также