Миноги рода Lethenteron Creaser et Hubbs
В водоемах Дальнего Востока, по современным представлениям, обитают четыре вида миног: Eudontomyzon morii; Lethenteron japonicum; L. kessleri;L. reissneri [Vladykov, Kott, 1979; Iwata et al., 1985]; описанный недавно вид Lethenteron matsubarai [Vladykov, Kott, 1978] мы включаем в синонимию L. kessleri в виду отсутствия каких-либо различий между ними. Согласно Л.С. Бергу [1948], на Сахалине должны встречаться все три упомянутых вида рода Lethenteron.
Со времени работ Л.С. Берга [1948, 1961, 1964] представления о систематике дальневосточных миног существенно изменились. Так, согласно системе родов, предложенной В.Д. Владыковым и У.И. Фоллетом [Vladykov, Follett, 1967], дальневосточные миноги выделены из рода Lampetra в роды Lethenteron и Eudontomyzon. Ареал L. reissneri в настоящее время ограничивают материковым побережьем к югу от устья Амура, Сахалином, Хоккайдо и северной частью Хонсю [Vladykov, Kott, 1979]. Ранее считалось, что эта минога распространена вплоть до Анадыря. L. kessleri, рассматривающийся Л.С. Бергом в качестве подвида L. japonicum, возведен в ранг вида [Полторыхина, 1974,1979; Nakamura, 1963; Iwata et al., 1985]. Основанием для этого послужило обширное перекрывание ареалов.
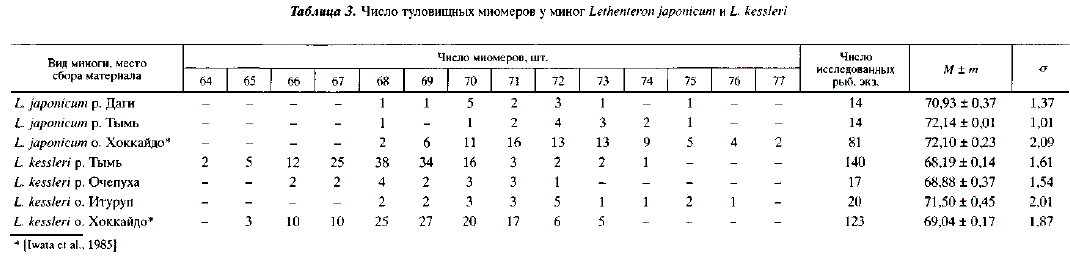
В пределах рода Lethenteron L. reissneri диагностируется по числу туловищных миомеров, которых бывает 56-67. У L. kessleri их насчитывается 65-73, у L. japonicum — 68-77 [Берг, 1961; Iwata et al., 1985]. Неперекрывание этого признака у L. reissneri и L. kessleri составляет более 99 %. L. kessleri и L. japonicum диагностируются по длине тела половозрелых особей. Длина особей первого вида не бывает более 23 см, длина второго — менее 23 см [Морозова, 1956; Полторыхина, 1973,1974; Савваитова, Максимов, 1978]. Необходимо отметить, что в первоописаниях L. reissneri и L. kessleri [Dybovski, 1869; Дыбовский, 1877; Аникин, 1905] число туловищных миомеров не указывалось. Не указывалось оно и в ряде более поздних работ [Абакумов, 1960]. Поэтому не всегда бывает ясно, с каким видом авторы имели дело. Если в отношении L. kessleri этот недостаток был восполнен последующими сборами, то в отношении L. reissneri нам представляется насущно необходимым получение экземпляров из типового местообитания — рек Онон и Ингода, расположенных в верхней части бассейна Амура. Весьма вероятно, что в дальнейшем, при использовании для диагностики числа туловищных миомеров, к L. kessleri будет отнесена часть миног, принимаемых ранее за L. reissneri.
Вопрос о видовой самостоятельности и практическом распознавании L. japonicum и L. kessleri осложняется, однако, известными случаями их совместного нереста [Савваитова, Максимов, 1978] и наличием у L. japonicum особей, созревающих в пресных водах, по длине тела не отличающихся от L. kessleri [Iwata, Hamada, 1986].
Нами исследовались миноги из сахалинских рек, впадающих в Охотское море (Тымь, Нерпичья, Мелкая, Очепуха) и в залив Анива (Шешкевича, ручьи, впадающие в озеро Табисанское), а также ручьевая минога с острова Итуруп. Наиболее подробно изучались миноги рек Тымь и Очепуха, из остальных водоемов имелись лишь небольшие пробы.
При анализе мы измеряли длину тела, подсчитывали число боковых губных зубов, зубов на нижнечелюстной пластинке (при этом краевые зубы, обычно раздвоенные, при статистической обработке принимались за один зуб), отмечали наличие или отсутствие
нижнегубных зубов, подсчитывали число туловищных миомеров. Нижнегубные зубы были обнаружены у всех исследованных особей. Число боковых губных зубов оказалось признаком малоинформативным из-за крайне слабой изменчивости.
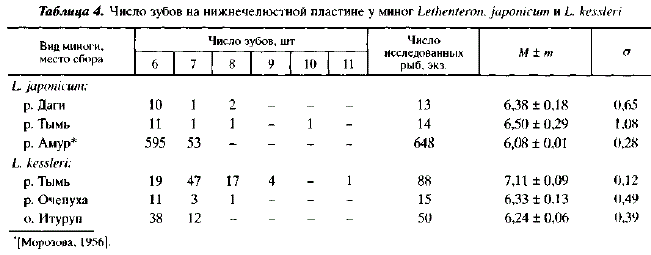
В результате предпринятых усилий в водоемах Сахалина были обнаружены два вида миног: L. kessleri и L. japonicum. Последний вид по числу туловищных миомеров не отличался от японских популяций (соответственно 68-75 и 68-77) [Iwata et al., 1985] (табл. 3). По числу зубов на нижнечелюстной пластине он был сходен с амурской миногой [Морозова, 1956]. Как на Сахалине, так и в Амуре резко преобладают особи, имеющие 6 зубов (табл. 4). Согласно данным А. Иваты с соавторами [Iwata et al., 1985], L. japonicum из рек острова Хоккайдо по числу зубов на нижнечелюстной пластине существенно отличается от особей из сахалинских популяций, хотя отсутствие указаний на систему подсчета зубов в статье этих авторов затрудняет сравнение. По размерам L. japonicum из р. Тымь близок к амурской миноге (длина половозрелых особей колеблется соответственно от 34 до 57 и от 30 до 55 см) и превосходит камчатскую миногу, длина которой колеблется от 23 до 32 см [Савваитова, Максимов, 1978]. У L. kessleri число туловищных миомеров составляло от 64 до 76, зубов на нижнечелюстной пластине от 7 до 11. У миног японских популяций число туловищных миомеров колебалось от 65 до 73 (см. табл. 3).
Поскольку факты совместного нереста ставят под сомнение видовую самостоятельность L. kessleri и L. japonicum, мы прежде, чем пытаться оценить их таксономические отношения, охарактеризуем отношения репродуктивные и дадим краткую характеристику образа жизни.
Нерестовый ход L. japonicum в р. Тымь начинается осенью, прекращается в зимние месяцы и возобновляется в мае. Производители, зашедшие в реку осенью, встречаются в январе в 70 км от устья. В малых реках (Очепуха) отмечается только весенний заход производителей. В больших реках минога поднимается до самых верховьев, заходя во все крупные притоки, в малых реках нерестилища начинаются в нескольких километрах от устья.
Сроки нереста проходной и ручьевой миног совпадают. На южном Сахалине нерест происходит во второй половине мая — первой половине июня, на северном — в июне — первой половине июля. Температура воды на нерестилищах колеблется от 8 до 15°С.
В массе ручьевая минога нерестует на меньшей глубине, чем проходная, и при меньшей скорости течения, предпочитая мелководные протоки. В основном русле рек гнезда ручьевой миноги располагаются обычно на мелководье у берегов. Глубина воды в местах нереста колеблется от 15 до 60 см, скорость течения — от 0,3 до 1,5 м/с. Проходная минога предпочитает стрежневые участки, избегая однако стремнин. Скорость течения на нерестилищах 0,4-2,0 м/с, глубина воды — 20-80 см.
Нерестовое гнездо проходной миноги представляет собой вырытую производителями ямку глубиной до 10 см, диаметром около 40 см. Ввиду малочисленности проходной миноги на Сахалине гнезда ее часто расположены одиночно, на большом расстоянии друг от друга. Однако в годы с повышенной численностью встречаются скопления гнезд (до 5-7 на 100 м). Количество производителей, одновременно находящихся на одном гнезде, по нашим наблюдениям, не превышало 8 экз. Обычно же их насчитывается 4-6 экз. Нередки гнезда, на которых нерестует лишь пара производителей. Соотношение полов бывает различным, например, 2 самки и 5 самцов, 4 самки и 3 самца. Отмечаются случаи, когда одно гнездо в течение нерестового периода используется неоднократно производителями разных сроков подходов.
Нерест ручьевой миноги в реках Тымь и Очепуха имел различия, которые, возможно, связаны с особенностями морфологии этих водоемов, а также с различиями в численности производителей (в реке Очепуха численность меньше). В бассейне Тыми нерестилище ручьевой миноги обычно представляет собой участок мелкого плеса с относительно быстрым течением. Длина таких участков (по течению) составляет 10-15 м, ширина 2-3 м. Гнезда концентрируются на стрежне. Расстояние между подобными нерестилищами составляет от 50 до нескольких сотен метров. На каждом нерестилище находится от нескольких десятков до двух-трех сотен производителей. В пределах нерестилища они держатся группами. По периферии располагаются одиночные особи и пары производителей, ближе к центру находится несколько групп по 3-4 производителя, центр нерестилища занимают 1-3 группы, в каждую из которых входят от 20-30 до 100-120 особей. Все производители заняты устройством гнезд, благодаря чему площадь нерестилищ оказывается свободной от ила, что, несомненно, улучшает водообмен и газовый режим в гнездах.
Гнезда, на которых находятся большие скопления производителей, представляют собой ямки глубиной 5-10, длиной 25-30, шириной 20-25 см. Гнезда, на которых находятся 1-3 производителя бывают меньших размеров (примерно 10 х 15 см). В пределах нерестилища от 5 до 20 особей в течение 10 мин перемещаются с гнезда на гнездо, обычно присоединяясь к наибольшим скоплениям или отделяясь от них. Реже происходят их перемещения между гнездами, на которых находятся 1-3 производителя. Соотношение полов на отдельных гнездах не подчиняется какой-либо закономерности. В целом же в нерестовом стаде ручьевой миноги численно преобладают самцы. В 1984 г. они составляли 67,5 %, в 1988 — 68,1 %. Доля самцов увеличивается к концу нереста. Численное преобладание самцов на нерестилищах отмечалось у разных видов миног [Абакумов, 1960; Dendy, Scott, 1953; Hardisty, 1961]. Это происходит как вследствие изначально большей численности самцов, так и вследствие их способности задерживаться на нерестилищах, нерестуя со вновь подошедшими самками [Смирнов, 1954].
В Очепухе ручьевая минога не образует таких больших концентраций, как в Тыми. Отдельные нерестилища в Очепухе гораздо меньше по размерам. Их длина не превышает 2-3 м, ширина — 0,5-1,0 м. Обычно же это единичные гнезда или компактно в цепочку расположенные 2-3 гнезда. Одновременно на нерестилище находится не более 10-15 производителей, чаще бывает 4-5 особей. В одно гнездо в течение сезона нереста поочередно откладывают икру несколько самок. Если первые производители строят гнездо около суток, то последующие лишь подновляют его в течение 1-2 ч. Нам довелось наблюдать, как имевшиеся на обширном плесе Очепухи четыре гнезда ручьевой миноги в течение нерестового сезона неоднократно использовались производителями, которые предпочитали выметывать икру на уже расчищенных площадках, а не устраивать новые. Эти гнезда находились на значительном расстоянии друг от друга и зрительно были трудноразличимы для плывущих у дна миног. Особенно трудно было распознавать гнезда в те дни, когда они пустовали, поэтому можно предположить, что производители обнаруживали их по запаху или по другим информативным следам [Наумов, 1973; Шилов, 1977].
Таким образом, особям как ручьевой, так и проходной миноги, подходящим на нерест, свойственно присоединяться к уже нерестующим производителям, образуя на гнезде многочисленные группы. Кроме того, миноги часто повторно используют нерестовые гнезда, на которые они, видимо, привлекаются запахом отложенной ранее икры. Этим характер повторного использования гнезд миногами отличается от такового у лососей рода Oncorhynchus. У горбуши, например, в годы высокой численности перекапывание гнезд не имеет прицельного характера. У осенней кеты оно может быть прицельным, но ориентированным в первую очередь на выходы грунтовых вод, а не на следы нерестовой деятельности других производителей.
Способность миног привлекаться нерестующими особями и построенными ранее нерестовыми гнездами следует иметь в виду при анализе случаев совместного нереста особей проходной и ручьевой формы. Последний в реках Сахалина — явление обычное. Мы наблюдали совместный нерест в бассейне Тыми, сотрудники СахТИНРО А.И. Жульков и А.А. Ковтун [личное сообщение] наблюдали его в реках Нерпичья и Богатая.
При совместном нересте встречаются гнезда, на которых находятся как самцы, так и самки обеих форм, а также гнезда, где каждая форма представлена особями лишь одного пола, например, 1 проходной самец и 3 ручьевых самки, 3 проходных самки и 4 ручьевых самца. Следует, однако, заметить, что соотношение полов определялось нами в момент облова гнезда. Вполне допустимо, что в дальнейшем к нему подошли бы особи противоположного пола каждой формы.
Случаи совместного нереста проходной и ручьевой миног отмечаются чаще в маловодные, чем в многоводные годы. Это представляется естественным, так как в маловодные годы пересыхают многие мелкие протоки, где обычно нерестует ручьевая минога. В Тыми в 1988 г. совместный нерест наблюдался чаще, чем в 1984 г. Расходы воды в июне в эти годы в районе нерестилищ миног составляли соответственно 33,6 и 67,2 м/с. Как известно, при нересте самцы и самки миноги копулируют и оплодотворение икры происходит в момент ее вымета [Абакумов, 1960; Mclntyre, 1969; Hardisty, Potter, 1971a и др.]. Возможность успешной копуляции особей проходной и ручьевой форм, существенно различающихся по размерам, представляется сомнительной. Подобные сомнения высказывались ранее в отношении возможности гибридизации между Lampetra planed и Lampetra fluviatilis [Hardisty, 1969; Huggins, Thompson, 1970; Hardisty, Potter, 1971b]. Нам внешне успешной копуляции проходной и ручьевой миног наблюдать не доводилось.
Поскольку у миног не обнаружено регистрирующих структур, о возрасте их судят на основании анализа размерных рядов [Морозова, 1956; Абакумов, 1960; Кузнецов, 1971]. Ранее неоднократно высказывалось мнение, что метаморфоз у миног происходит лишь в одном возрасте, на пятом или шестом году у разных видов [Кузнецов, 1971]. Следовательно, нерестовое стадо ручьевых миног и покатная молодь проходных должны быть представлены единственной возрастной группой. Однако столь жесткая фиксированность метаморфоза и созревания у животных с подобной продолжительностью жизни представляется маловероятной. У рыб, предельный возраст которых достигает 6 лет, созревание происходит обычно в течение 2-3 лет.
Способность миног претерпевать метаморфоз и созревать в разном возрасте была доказана экспериментально на примере мичиганской пресноводной миноги Ichthyomyzon fossor [Purvis, 1970] и в дальнейшем принимается как очевидное явление [Seagle et al., 1982; и др.].
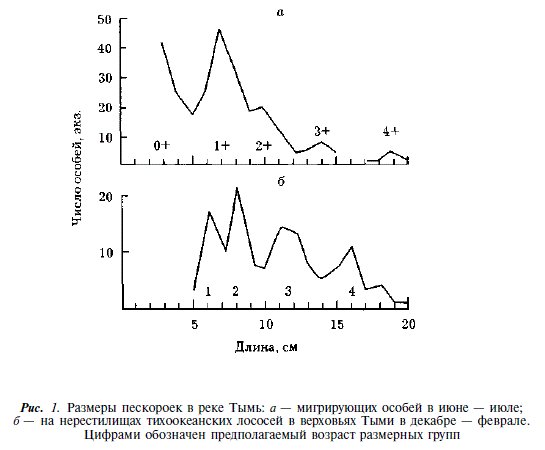
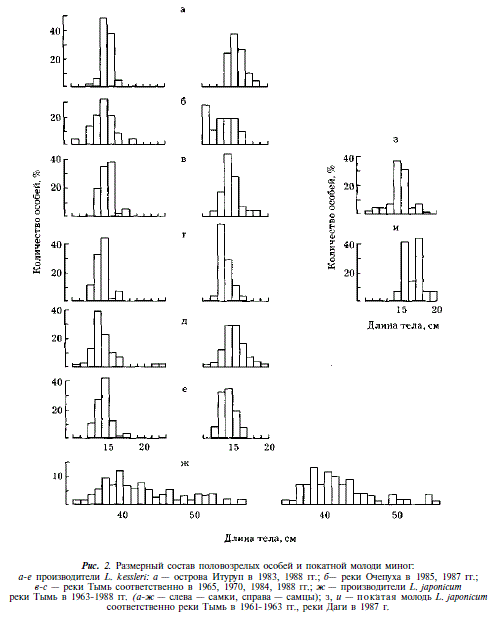
По нашим данным, предельный возраст пескороек (безотносительно видовой принадлежности) достигает 5 лет (4+) (рис. 1). Если допустить, что скорость роста пескороек проходной и ручьевой форм была одинаковой, то, сопоставляя размеры пескороек, производителей ручьевой и покатной молоди проходной миноги, можно прийти к выводу, что метаморфоз и созревание ручьевой миноги происходят в возрасте 3-5 лет (при этом основная масса созревает в возрасте 4 лет). Скат молоди проходной миноги в Тыми происходит преимущественно в 4-годовалом, а в Даги — в 5-годовалом возрасте (см. рис. 1 и 2).
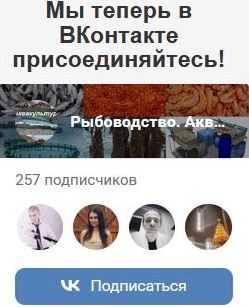
Принадлежность пескороек к проходной или ручьевой форме нами не определялась. Однако, исходя из подавляющего численного превосходства ручьевой миноги над проходной, не будет ошибочным утверждение, что среди пескороек преобладает ручьевая минога. Исходя из этого, представляется весьма вероятным существование у ручьевой миноги как жилых особей, так и особей-мигрантов. В районе нерестилищ нам встречались пескоройки всех размерных групп, в том числе крупные особи с признаками начавшегося метаморфоза. Эта группа миног не должна совершать протяженных миграций. Вместе с тем, при учете покатной молоди тихоокеанских лососей нами отмечалась миграция пескороек в нижнее и среднее течение Тыми, имеющая четко выраженную сезонную и суточную периодичность [Гриценко, 1968]. Эта миграция происходит в мае — июле. В пределах суток как в паводок, так и в межень пик ее отмечается в ночные часы (рис. 3). Последнее обстоятельство свидетельствует об активном характере подобной миграции. Среди мигрантов встречались все возрастные группы, включая сеголеток.
Экологический смысл подобной миграции заключается в рассеянии особей по участкам среднего и нижнего течения, наиболее богатым органическим илом, служащим пескоройкам кормом. Особи-мигранты ручьевой миноги должны для достижения нерестилищ преодолевать десятки километров. Аналогичные миграции совершаются также европейской ручьевой миногой [Malmqvist, 1980] и сибирской миногой Иртыша [Полторыхина, 1973 а, б].
Скат претерпевшей метаморфоз молоди проходной миноги начинается в III декаде мая и заканчивается к началу июля. Наибольшее количество покатников встречается в первой половине июня. Молодь во время ската придерживается фарватера, где распределяется по всей толще воды. Все случаи поимки покатной молоди имели место ночью и ранним утром.
Ранее нами описано сходство особенностей расселения пескороек и ската молоди миног, претерпевшей метаморфоз, со скатом молоди кеты и горбуши [Гриценко, 1968]. Этим мы дополнили картину экологического параллелизма между миногами и лососями, описанного Л.С. Бергом [1932].
Проходная минога в период обитания в море по характеру питания является эктопаразитом рыб, потребляющим их ткани и кровь. Жертвами миноги становятся как мелкие рыбы (тихоокеанская корюшка), так и крупные (тихоокеанские лососи) [Бирман, 1950; Никольский, 1956а]. Европейская речная минога Lampetra fluviatilis, напоминающая по образу жизни L. japonicum, нападает преимущественно на мелкую рыбу — сельдь и корюшку [Эглите, 1958; Чертов, 1963]. Весьма вероятно, что преимущественное потребление мелкой рыбы свойственно и L. japonicum. Однако после нападения миног мелкие особи гибнут, и оценить их роль в рационе миног трудно. Судя по следам миножьих присосок на теле рыб, в прибрежных водах Сахалина наиболее часто подвергаются нападению миног относительно мелкие лососевые рыбы (горбуша и голец); травмированность первой достигает 33,4 %, второго — 46,8 %. Травмированность более крупных лососей — кеты и кижуча гораздо ниже (табл. 5).
Закончив краткий обзор образа жизни сахалинских миног, вернемся к вопросу о таксономических отношениях между L. japonicum и L. kessleri. Описанные выше особенности их нерестового поведения позволяют двояко оценить их репродуктивные отношения. Так, можно предположить, что проходная и ручьевая миноги чисто механически используют общие гнезда, не скрещиваясь при этом; что следы нерестовой активности или присутствие нерестящихся особей являются для них привлекающими факторами, активизирующими производителей, репродуктивная же обособленность при этом сохраняется. В пользу такого предположения свидетельствует разница в размерах тела проходной и ручьевой миног. С другой стороны, можно предположить, что совместный нерест является свидетельством репродуктивного единства. Однако при успешной гибридизации проходной и ручьевой миног между ними должно иметься значительное фенотипическое сходство. В Тыми подобного сходства мы не наблюдали. Проходная и ручьевая миноги достоверно различаются по числу туловищных миомеров (td = 28,15; Р = 0,01), причем общее неперекрывание составляет более 90 % {CD = 1,51) (см. табл. 3). Также существенно различие в числе зубов на нижнечелюстной пластине (t= 2,01; Р = 0,05), общее неперекрывание составляет 70 % (см. табл. 4). Эти различия свидетельствуют в пользу репродуктивной обособленности проходной и ручьевой миног в бассейне Тыми, а размеры половозрелых особей могут быть использованы как диагностический признак.
Однако число туловищных миомеров и зубов на нижнегубной пластине у ручьевой миноги подвержено значительной географической изменчивости. Так в Очепухе ручьевая минога не отличается от L. kessleri из Тыми по числу туловищных миомеров, но по числу зубов на нижнечелюстной пластине сходна с L. japonicum из рек Тымь и Даги. Ручьевая минога из водоемов острова Итуруп как по числу туловищных миомеров, так и по числу зубов на нижнечелюстной пластине напоминает проходную миногу из рек Тымь и Даги (см. табл. 3 и 4). Последнее обстоятельство формально позволяет относить ручьевую миногу острова Итуруп как к L. kessleri, так и к L. japonicum, чьей пресноводной формой она, возможно, является. Если в дальнейшем оправдается последнее предположение, то размеры тела половозрелых особей нельзя будет использовать как диагностический признак, позволяющий различать L. japonicum и L. kessleri.
Таким образом, на сегодня существование вида L. kessleri нам представляется реальным, а ручьевой пресноводной формы L. japonicum — вероятным. Возможность существования последней, затрудняя диагностику, не опровергает факт реальности вида L. kessleri.
Остановимся кратко на аномалиях строения зубов у L. kessleri. Л.С. Берг [1948] приводит описание экземпляра ручьевой миноги из Тыми, у которого нижнегубные зубы расположены в несколько рядов, допуская, что это может быть новый вид. Среди просмотренных нескольких сотен экземпляров ручьевой миноги из Тыми нам встретилась особь с двумя рядами нижнегубных зубов, но, кроме того, отмечены особи с промежуточным состоянием этого признака. Так, у двух экземпляров между нижнегубными и краевыми зубами имелось несколько мелких случайно расположенных зубов. У одного экземпляра линия нижнегубных зубов разделялась на две в средней части и соединялась у конца (рис. 4). Редкость подобных форм и наличие нескольких переходных состояний признака позволяют утверждать, что мы имеем дело не с новым видом, а с индивидуальными аномалиями признака у L. kessleri.
Парные виды миног — явление, при котором проходному паразитическому виду сопутствует близкородственный непаразитический ручьевой вид, — широко распространены в сем. Petromyzonidae. Впервые на этот феномен обратил внимание Г. Цанандреа в 1959 г. [цит. по Hardisty, Potter, 1971b]. В свете современных знаний, уместнее говорить о "букетах видов", когда у одного паразитического вида имеется несколько родственных ручьевых непаразитических видов. Подобные "букеты видов" В.Д. Владыковым и Е. Коттом [Vladykov, Kott, 1979] рассматриваются в качестве родов и, по сути дела, составляют основу предложенной ими системы сем. Petromyzonidae. Сама широта распространенности этого явления среди миног разного эволюционного возраста говорит об известном единстве пути видообразования в данной группе животных. Подобное не удивительно, так как краткость периода размножения, однократность нереста, годичный интервал между нерестовыми сезонами, созревание в разном возрасте и при разных размерах тела, а также ассортативность скрещивания создают благоприятные условия для действия диеруитивного отбора [Hardisty, Potter, 1971a,b].
По мнению одних исследователей, ручьевые миноги произошли от проходных [Полторыхина, 1979]. В пользу этого предположения говорит наличие зубов у непаразитических хилых миног. По мнению других, проходные и ручьевые миноги происходят от общего политипического предка [Кузнецов, 1971]. Однако все авторы сходятся на том, что основную роль в видообразовании играли онтогенетические перестройки, связанные со сдвигами сроков метаморфоза и созревания. В частности, одним из путей образования карликовых ручьевых миног служило ускорение созревания половых продуктов после метаморфоза.
По К.М. Завадскому [1968], виды, подобные непаразитическим видам миног, могут образовываться от предковой формы политопно и полихронно, сохраняя при этом в однообразной экологической среде определенное генетическое однообразие, поскольку происходят из одного и того же генетического материала. Подобные взгляды разделяются последующими исследователями [Hardisty, 1987].
Естественно также допустить, что из общего предка могут происходить и разные виды. Такими видами в роде Lethenteron являются L. reissneri и L. kessleri. L. reissneri, обитающий на юге родового ареала и обладающий чертами южной формы (малое число туловищных миомеров), подобен описанной в этой работе южной форме ручьевого гольца Т. Salvelinus, T. alpinus. По всей вероятности, L. reissneri является автохтоном Японского моря и сопредельных частей Охотского моря.
В заключение добавим, что проходная минога на Сахалине в силу своей малочисленности не имеет промыслового значения.