Происхождение амурских стад горбуши, кеты и симы
Период до 1920-х гг. считается временем биологов-описателей, биологов-искателей и, как тогда говорили, испытателей природы. К концу ХХ в. биологи-систематики совершенно серьезно считали, что описательный период в биологии уже окончился. Многих вопросов, касающихся популяций, не смогли решить до того, как появились методы, основанные на знаниях о свойствах ДНК. Они сильно изменили прежние представления о систематике рыб, в том числе и тихоокеанских лососей.
Генетика поднимает систематику на новый уровень. В конце 1980-х гг. выяснилось, что в род тихоокеанские лососи — Oncorhynchus — необходимо включить форелей (Smith, Stearly, 1989).
Теперь род называется «тихоокеанские лососи и форели» и состоит как минимум из 8 видов (Животовский, 2015). Для рыбного хозяйства знания о популяциях были важны, так как именно эта группировка и есть минимальная единица эксплуатации. Чтобы обосновать допустимый улов какой-либо рыбы, необходимо знать географические границы популяции этой рыбы, ее структуру и численность. Без знаний о популяциях (о них до сих пор знаний мало) в те времена обходились условностями. Многие группировки тихоокеанских лососей называли по времени нерестового хода, например: осенняя горбуша р. Большой или летняя кета Амура (Кузнецов, 1928; Кагановский, 1949). Это был как бы микровзгляд из устьев рек. Макровзгляд из океана сформировал новые названия некоторых группировок — по месту их морского нагула. Например, япономорская горбуша, тихоокеанская горбуша.
Современная рыбохозяйственная наука почему-то называет амурскую горбушу япономорской, хотя основной ее ход ежегодно отмечается из Охотского моря со стороны северной оконечности о. Сахалин. На самом деле известны несколько рыб, помеченных в Японском море и затем обнаруженных в Амурском лимане. Но чтобы выяснить этот вопрос о япономорском или тихоокеанском нагуле горбуши, нужно метить рыб на путях их миграций, в том числе и в спорных районах, и параллельно вести генетические исследования, а они до сих пор не сделаны. Пока ученые спорят, у простых рыбаков есть все основания считать: если горбуша мигрирует вдоль о. Сахалин, она — сахалинская; та, что входит в малые реки Амурского лимана, — лиманская; а та, что вошла в устье Амура, — амурская.
Двадцать первый век изменил и упростил определение термина «популяция». С точки зрения генетиков, популяция — это совокупность особей, предки которых в течение многих поколений обитали в сходных условиях и воспроизводились внутри одних и тех же группировок (Животовский, 2016). Географические границы и экологические адаптации — один из путей формирования популяций. Например, рыбаки, взяв за критерий сроки нерестовой миграции, считают, что в Амуре имеются две группировки кеты — летняя и осенняя. Но биологи, взяв за основу экологические особенности нереста (в которых содержатся географические границы и экологические адаптации), считают, что в Амуре нужно выделить четыре группировки кеты (табл. 2), которые отделены друг от друга темпорально и экологически.
Лососи — сравнительно молодая группа рыб. Костистые рыбы существуют чуть менее 300 млн лет (Betancur et al., 2013) а лососевые — всего лишь чуть более 40–45 млн лет (Животовский, 2015). Их ископаемые останки находят в тех же районах, где они обитают и ныне (Черешнев, 1998). Вероятно, главным критерием в выборе рек у лососей является наличие условий и мест, пригодных для воспроизводства. Современный же облик рек (и мест нереста) начал возникать в плейстоцене около 2 млн лет назад, когда климат стал более влажным и прохладным. Дождевые потоки и паводки обеспечивали размыв горных пород, их транспорт по руслу и накопление аллювиальных масс, пригодных для строительства нерестовых гнезд.
Группировка кеты Миграция в устье Амура Период нереста
Летняя подрусловых
источников Конец июня – июль Конец июля – август
Осенняя подрусловых
источников Сентябрь Сентябрь
Осенняя речных ключевых
источников Конец августа – октябрь Сентябрь-ноябрь
Осенняя озерных ключевых
источников Октябрь Октябрь-ноябрь
О первой колыбели лососевых рыб в Азии говорить пока трудно: слишком мало палеонтологических находок. Расцвет прародителей тихоокеанских лососей, вероятно, относится к среднеэоценовому времени (эпоха процветания кистеперых рыб), в отложениях которых на берегах Тихого океана на Камчатке была найдена рыба Eosalmo kamchikensis (Sytchevskaya), а на другой стороне океана в Канадской провинции Британская Колумбия — Eosalmo driftwoodensis (Wilson) (Черешнев, 1998).
Перволососи были озерными и речными рыбами и нерестились в притоках рек и озер. Возраст рода Oncorhynchus (тихоокеанские лососи) ещё моложе: судя по находкам в Приморье и на о. Хоккайдо, не позднее, чем поздний олигоцен — миоцен (Neave, 1958; Глубоковский, 1995; Черешнев, 1998; Шедько и др., 2013), т.е. не более 20 млн лет. Древние виды этого рода вымирали. Современные виды рода Oncorhynchus намного моложе — их возраст 10–12 млн лет (Шедько и др., 2013). Как отдельный вид, вероятно, первой от родового древа 12 млн лет назад отделилась сима (Глубоковский, 1995; Животовский, 2015). Считается, что горбуша и кета — одни из самых молодых видов тихоокеанских лососей, они возникли в самом конце миоцена, менее 10 млн лет назад (Животовский, 2015).
Если бы даже в те времена, 10–12 млн лет назад, в палеоАмуре появилась кета, она не смогла выходить в океан, а попадала в теплое палеоЖелтое море. Амур в дочетвертичное время имел совершенно другие очертания. Полагается, что, сливаясь с палеоЗеей, палеоАмур стекал на юг, через районы современного среднего течения р. Сунгари в р. Ляохе и впадал в Желтое море недалеко от устья р. Хуанхэ (рис. 7) (Махинов, 2006). В палеоАмуре преобладали теплолюбивые рыбы: сомы, змееголовы, косатки, карповые и др. (Берг, 1909, 1948), что указывает на некомфортность бассейна палеоАмура для тихоокеанских лососей. Река, на берегах которой ныне стоят города Хабаровск, Комсомольск-на-Амуре и Николаевск-на-Амуре, дочетвертичного периода называется палеоСунгари. Она и ее приток палеоУссури не подвергались оледенению. Река впадала в более холодное Охотское море, и климат в низовьях ее бассейна был более прохладный из-за близости к морю. Здесь у холодноводной кеты было гораздо больше шансов прижиться и создать популяцию. Только в четвертичное время геологические и русловые процессы сформировали современное русло Амура: реки Сунгари и Уссури стали притоками современного Амура.
В четвертичное время начались регулярные оледенения. Последние 1,8 млн лет северная часть Тихого океана регулярно испытывала оледенения и потепления. Последние 400 тыс. лет это происходило регулярно каждые 100 тыс. лет (рис. 8). В районе Берингова пролива появлялась суша, и материки соединялись. ПалеоОхотское море мелело, частично покрывалось сушей и изолировалось от океана. Остров Сахалин в палеоЯпонском море соединялся с сушей. В периоды оледенений лососевые рыбы, которым был необходим выход в океан на нагул, вымирали в более северных районах и выживали в более южных районах Северной Пацифики.
Таблица 2
Сроки миграции и нереста различных экологических группировок кеты в Амуре
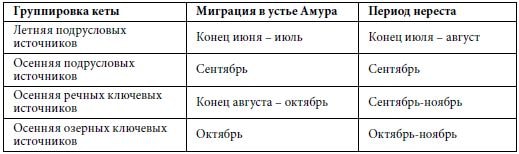
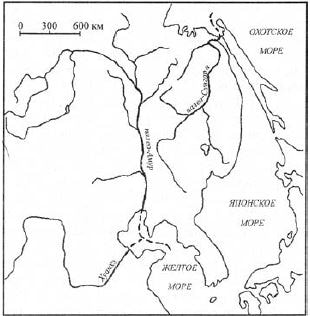
Рис. 7. Рисунок предполагаемой речной сети на территории современного бассейна Амура в дочетвертичное время (Махинов, 2006)
Амурская горбуша. Ранее ученые объясняли внутривидовое разнообразие (смежные поколения четных и нечетных лет, темпоральные расы, экологические предпочтения разных группировок в выборе места нереста и др.) высокой степенью миграции многочисленных популяционных группировок горбуши, которые, как утверждалось, обладали самым сильным стреингом среди тихоокеанских лососей. Но к концу ХХ в. генетические методы подтвердили, что смежные группировки амурской горбуши поколений четных (урожайных) и нечетных (неурожайных) лет — это две различные популяции. Это относилось и ко всему ее нативному ареалу (рис. 9).
Д.Ю. Чуриков (2001) анализировал изменчивость митохондриальной ДНК (мтДНК) горбуши и определил географическое распространение основных ее гаплогрупп по ареалу. Почти повсеместно была обнаружена низкая изменчивость мтДНК, что не подтверждало старую теорию о высокой степени миграции и обмена в популяционных группировках. Д.Ю. Чуриков (2001) объяснил низкую степень генетической дифференциации между популяциями горбуши их относительно недавним происхождением от небольшого числа предковых популяций, выживших в рефугиумах ледникового времени, которые послужили основой образования большого числа молодых популяций в плейстоцене. В Азии рефугиумы горбуши, вероятно, находились в местах с наиболее теплым климатом — в реках Сахалина и Курильских островов. И в Северной Америке такие места тоже были найдены по уникальному набору гаплотипов (Чуриков, 2001).
На фоне последних генетических данных можно представить картину появления горбуши в Амуре. До плейстоценового времени группировки горбуши, возраст образования которой как вида составляет 10–12 млн лет, уже не раз вымирали в азиатской части ареала из-за периодических процессов, сопутствующих ледниковым периодам: понижение уровня океана, осушение больших участков морей, отделение морей от океанов участками новой суши, фрагментация ареала. Большое число популяционных группировок вымирало; может, такое не раз случалось и в Амуре. В некоторых акваториях, расположенных южнее, например в районе современного Сахалина, сохранялись условия, где часть популяций горбуши выживала. После периодов оледенений с новым наступлением моря популяционные группировки горбуши, выжившие в рефугиумах, начинали мощную по темпам колонизацию северных районов, образуя молодые родственные группы, каждая из которых имела общего материнского предка, выжившего в рефугиуме. Можно полагать, что Амур был заселен близкородственными группировками тихоокеанской горбуши в относительно недавнее время — после последнего крупного оледенения.
Это было Висконсинское оледенение, которое произошло 50 тыс. лет назад, и примерно с этого времени горбуша начала очередную интенсивную колонизацию Амура.
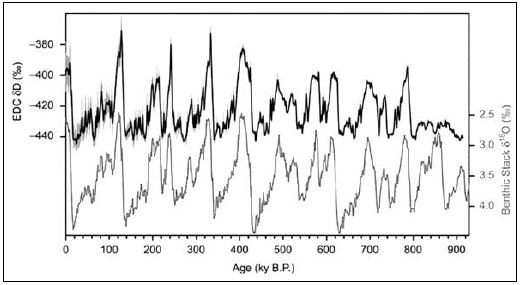
Рис. 8. Многолетний ход двух независимо полученных показателей, характеризующих изменения температуры за 800 тыс. лет в районе Антарктиды. По оси абсцисс — возраст отложений в тысячах лет до настоящего времени (т.е. ход времени — справа налево). Черная линия — данные по относительному содержанию дейтерия δD в колонке льда с Европейской станции (EPICA) на куполе «С». Синяя линия — данные по относительному содержанию тяжелого изотопа кислорода δ18О в донных отложениях в Южном океане (в последнем случае — инвертированная шкала). Пики на обеих линиях соответствуют потеплениям (Jouzel et al., 2007)
Япономорская горбуша (группировки, нагул которых происходит в Японском море) в доплейстоценовое время не могла проникать в Амур напрямую через прол. Невельского из-за того, что в Татарском проливе до недавнего времени оставались участки суши. Для этого рыбам нужно было выходить в Охотское море, мигрировать вдоль восточных берегов Сахалина и обходить его северную оконечность. И в настоящее время япономорская горбуша, если и мигрирует в Амурский лиман или в Амур, то следует древним путем: вдоль восточного побережья Сахалина, огибая его северную оконечность (рис. 10). Исследовавшие этот вопрос в ХХ в. И.Ф. Правдин (1932), а затем Г.В. Новомодный (2003) не отмечали мигрирующей через прол. Невельского горбуши в количествах, адекватных запасам Амура или рек Амурского лимана. Присутствие современных япономорских группировок горбуши в Амуре только предполагается в объеме не более 1/7 от общего (Новомодный, 2003), но никем еще не доказано.
Вероятно, только мечение или генетические методы смогут прояснить этот вопрос.
Осенняя кета. С той поры, когда генетики обнаружили уникальные наследственные свойства мтДНК, которые передаются только по женской линии, в каждой группировке животных стало возможным выявить линию основательницы и время образования вида. Российские исследователи тихоокеанских лососей тоже задались вопросом: «Где находится колыбель азиатской кеты, может в р. Амур?» Генетики Института биологии моря ДВО РАН (г. Владивосток) Н.Е. Полякова с соавторами (2006) собрали и проанализировали пробы кеты с большей части ее азиатского ареала (рис. 12). Популяции азиатской кеты сформировались в два кластера родственников, один из которых был образован только япономорскими группировками, предположительно принадлежавшими к р. палеоСуйфун, другой — группировками Амура, о. Сахалин и побережья Охотского моря. Летняя кета Амура оказалась близка к популяциям побережья Охотского моря и летней кеты р. Тымь (северо-восточный Сахалин), впадающей в Охотское море. Это было и неудивительно: еще в недалеком прошлом о. Сахалин был соединен с материком (рис. 11).
Осенняя кета Амура оказалась близка к большинству сахалинских группировок осенней кеты.
Исследователи выяснили, что генетический обмен между япономорскими и охотскими группировками кеты отсутствовал (или был незначителен) на протяжении многих поколений. Исходя из предположения, что нуклеотидные замены в мтДНК у позвоночных происходят со скоростью 2 % за 1 млн лет, время возникновения япономорской и амурской группировок кеты генетики определили в 350–450 тыс. лет назад (Полякова и др., 2006). Может быть, кета обитала здесь и ранее, но, вероятно, потомки от той матери-основательницы вымерли, и, увы, генетической памяти о ней в мтДНК амурской кеты не сохранилось. Опираясь на современные представления о рельефообразовании в бассейне Амура (Махинов, 2006) и картину древних оледенений в Северной Пацифике (Черешнев, 1996; Augerot et al., 2005), можно утверждать, что реки палеоСунгари и палеоУссури, притоки современного Амура, могли являться первыми нерестовыми бассейнами для крупных группировок осенней кеты, которые воспроизводились там на ключевых источниках во времена послеледниковых потеплений и, вероятно, не раз давали начало амурской кете как популяции. Аналогично япономорская кета после оледенений в первую очередь осваивала р. палеоСуйфун и в периоды потеплений распространялась далее по Японскому морю.
В дискуссии, какая форма кеты первая освоила бассейн Амура, кроме генетических аргументов, существуют и очень весомые геоморфологические. Кета не могла освоить притоки нижнего Амура прежде чем в позднечетвертичное время: там еще не произошло формирование достаточных толщ аллювиальных масс. Только в условиях новых ландшафтов, на галечных отложениях достаточной толщины смогла возникнуть новая экологическая форма амурской осенней кеты, которая использовала для нереста не районы выхода ключей, а районы с сильным и устойчивым подрусловым потоком воды. До настоящего времени именно эта форма является доминирующей по численности в бассейне Амура. Здесь она распространена от р. Анюй до устья Амура. Наиболее типичными участками для осенней кеты, нерестящейся в ключах, являются бассейны рек Уссури и Сунгари. Наиболее типичным участком для осенней кеты, нерестящейся на напорных подрусловых водах, является бассейн р. Амгунь.
Летняя кета. Исследуя историю формирования ихтиофаун мира, Г.У. Линдберг (1972) отметил, что летняя форма кеты географически ограничена двумя бассейнами — палеоАмур и палеоЮкон, а районы их морского нагула различны. Это было ключом к разгадке географических границ двух популяций летней формы кеты. Причины возникновения этих форм в палеоАмуре и палеоЮконе крылись в сходном облике бассейнов и в сходном рельефообразовании в условиях аллювиальной аккумуляции. Скорость транспорта рыхлых отложений в низовьях этих бассейнов оказалась меньше скорости их аккумуляции. Сотни тысяч лет происходила аккумуляция аллювиальных масс, через которые дренировали напорные подрусловые воды и создали в этих двух бассейнах условия для воспроизводства особых группировок кеты. В низовьях Амура осенняя амурская кета и летняя амурская кета часто нерестятся на сходных местах (подрусловые напорные воды). Нужно добавить, что американские рыбаки не разделяют выловленную в р. Юкон кету на летнюю и осеннюю, хотя хорошо знают о них. В статистике их уловов также невозможно найти раздельные данные об этих формах. Это оказалось интересно лишь ихтиологам.
В течение последних 350–400 тыс. лет в Амуре условия среды позволяли существовать только той форме кеты, которая откладывала икру в ключах притоков. Летняя амурская кета (судя по раннему времени ее нерестового хода) стала основателем охотоморской кеты. В последние 50 тыс. лет условия среды изменились настолько, что появилась амурская летняя кета, которая смогла выделиться в отдельную группировку в Амуре более ранним временем нерестового хода, размножиться и освоить освобождающиеся от ледников новые пространства в Охотском море.
Получается, что летняя кета в жесткой конкуренции с осенней освоила все тот же район низовий Амура, где на участках с подрусловым потоком уже нерестилась осенняя кета. Появление большого числа близкородственных гаплотипов, которое характерно при освоении видом новых регионов, свидетельствует, по мнению генетиков, об экспоненциальном росте численности охотоморской кеты в реках побережья Охотского моря в недавнее голоценовое время — последние 50 тыс. лет — после Висконсинского оледенения (Полякова и др., 2006). Современные нерестилища охотоморской кеты в реках Иска, Коль, Тугур, Уда почти ничем по виду не отличаются от амгуньских. Итак, именно амурская летняя кета быстро освоила низовья Амура и затем широко распространилась к северу — по рекам освобождающегося от ледников побережья Охотского моря. Амурская летняя и охотоморская формы кеты в настоящее время наиболее распространены и обильны. Сейчас эти рыбы составляют основу промышленных уловов кеты в Хабаровском крае, Магаданской области, на западном побережье Камчатки по побережью Охотского моря и в Амуре.
Сима — наиболее тепловодный лосось. Миллионы лет назад в относительно теплых широтах к югу от устья Амура существовала огромная лагуна с солоноватой водой. В эту лагуну впадали небольшие, до 250 км длиной, реки. Лагуна соединялась с океаном лишь двумя проливами. Это было палеоЯпонское море с проливами между нынешним п-овом Корея и Японией и между нынешними островами Сахалин и Хоккайдо. Вероятно, где-то на побережье о. Хонсю (сейчас там отмечают наибольшее разнообразие подвидов симы) несколько миллионов лет назад вселился самый древний вид из тихоокеанских лососей — сима. Это была небольшая, до 30 см, хищная рыбка из рода тихоокеанских лососей. Она жила в системах «река–озеро» 3–4 года, нерестилась каждый год, питаясь молодью рыб, амфибиотическими (развивающимися в воде) насекомыми и их личинками. Физиологические свойства, присущие анадромным рыбам, позволяли ей жить и в морской воде. Сима, обладая свойственным тихоокеанским лососям мощным потенциалом роста, каждый месяц пребывания в море прибавляла в длину тела и в массе. Рыбы созревали уже после первой зимовки в море и возвращались к «родным» рекам нереститься. Вероятно, лучше выживали те рыбы, которые уходили не слишком далеко от проливов. По этой причине места зимовки симы и в настоящее время остаются не очень удаленными от тех проливов, которыми молодь уходила в океан из Японского моря (рис. 13). Часть этих рыб оставалась пресноводными (жилые карликовые рыбы), но их потомство обладало свойством жить в соленой воде.
Ныне живущие популяции симы состоят из анадромных особей (крупных рыб, нагуливающихся в море) и карликовых пресноводных особей (мелких рыб, не выходящих из пресных вод). В реках северной части ареала почти все особи симы — анадромные рыбы и доля карликовых самцов невелика. Самая северная находка карликовой самки — в р. Киевка (около 42° с.ш.) на материковом побережье Японского моря (Иванков и др., 1981). Далее на юг по ареалу сима легко образует озерные популяции в водохранилищах.
Для Японии (о. Хонсю и южнее) и п-ова Корея доля карликовых особей значительно больше доли анадромных; жилая сима (пресноводная карликовая форма) — весьма типичное явление на юге Японии. Там существуют три подвида симы: O. masou masou Brevoort, 1856 (анадромная сима); O. masou ishikawae Jordan & McGregor, 1925 (речная сима Японии); O. masou subsp. (жилая сима оз. Бива). На самом юге ареала (о. Тайвань) анадромных рыб не отмечается, вместо них в реках обитает мелкая жилая сима O. masou formosanus Jordan & Oshima, 1919.
Интересен потенциал ее роста на о. Тайвань: отдельные рыбы достигают длины тела 30 см; и это тот самый предел, который определила эволюция той древней жилой симе, которая не выходила в море. Плодовитость жилых самок Тайваня составляет 200–500 икринок (Healey et al., 2017). Соотношение полов жилой симы о. Тайвань сдвинуто в сторону преобладания самок. Предельный возраст составляет 5 лет (4+). В отличие от других тихоокеанских лососей, жилая сима полициклична: самки и самцы не погибают после нереста. Самки нерестятся в возрасте 1+, 2+, 3+, т.е. три раза в жизни. Самцы нерестятся в возрасте 0+, 1+, 2+, 3 — четыре раза в жизни. Сходные свойства имеют жилые самцы симы оз. Бива, 10–20 % которых не погибает после нереста, а также 7 % жилой речной симы Японии, оба пола которой нерестятся три раза в жизни (Morita et al., 2017; Yamamoto et al., 2017). Вероятно, свойство полицикличности восстанавливается у жилой симы как древнее доанадромное свойство вида.
Когда сима могла прижиться в Амуре? В период плейстоцена она заселялась туда не один раз из расположенных на юге рефугиумов, но ее группировки периодически вымирали. Специалисты (Yu et al., 2010), исследовав мтДНК симы по всему ее ареалу, выявили схожесть ее ситуации с охотоморской кетой: после Висконсинского оледенения рыбы распространились из рефугиумов, быстро колонизируя более северные районы. У симы рефугиумы находились в реках или озерах Хоккайдо (16 гаплотипов из 20 существующих по ареалу). Вероятно, когда в период оледенения очередной раз вымерла амурская анадромная сима, на о. Хоккайдо благополучно «перезимовала», не выходя в море, жилая форма. Когда реки вновь потекли в море, от жилых особей родились рыбы, обладавшие свойствами анадромных рыб. Они стали продвигаться на север, осваивая освобождающиеся от ледников реки и оставляя потомство с большей долей анадромных рыб. Вероятно, последнее успешное заселение симы в Амуре произошло, как и у летней кеты, около 50–10 тыс. лет назад.
Многие биологи отметили удивительные сходства в хронологии эволюции тихоокеанских лососей и решили проверить их. Для сравнения выбрали виды, сильно различающиеся биологическими особенностями, историей происхождения и ареалом, — сахалинского тайменя и кету, и исследовали их эволюционный процесс анализом нуклеотидных последовательностей фрагментов мтДНК. Вероятно, часть популяций сахалинского тайменя тоже вымирала в период оледенений и, судя по пробам, первый этап дивергенции у сахалинского тайменя приходился на время 430 тыс. лет назад, второй — 220 тыс. лет назад, третий — 70 тыс. лет назад. Пробы кеты показали первый этап — 220 тыс. лет назад, второй — 100 тыс. лет назад. Основная доля выделяемых в настоящее время гаплотипов у обоих видов формировалась 50–10 тыс. лет назад, соответственно как четвертый и третий этапы их дивергенции. Исследователи поставили вопрос: какими факторами могли определяться этапы дивергентной эволюции? Они пришли к выводу, что наиболее значимыми событиями в истории Северной Пацифики в это время были изменения климата с периодом около 100 тыс. лет (см. рис. 8). Наступление ледников, падение уровня воды в океане и в связи в этим периодическая изоляция морей с опреснением воды — вполне могли быть теми факторами, которые определяли этапы дивергенции видов в этом районе. Считается, что 478–424 тыс. лет назад уровень воды в Японском море понизился на 100 м ниже современного из-за образования мощных ледниковых масс. Другой период похолодания, отмечавшийся 347–130 тыс. лет назад, понизил уровень Японского моря на 140–150 м ниже современного. Последнее (вюрмское) оледенение, происходившее в течение 98 тыс. лет, также приводило к снижениям уровня моря 50 и 25 тыс. лет назад (Korotky et al., 1997; Маляр, Брыков, 2016). Последний этап взрывного образования гаплотипов (5–10 тыс. лет назад), бесспорно, связан с отступлением ледников, образованием проливов Лаперуза и Сангарский и расширением ареалов лососей в голоцене (Маляр, Брыков, 2016).
Итак, последние 1,8 млн лет распространением и динамикой численности амурской горбуши, кеты и симы в северной части Тихого океана руководил регулярно меняющийся климат.
Замечательные приспособительные свойства, присущие морским бродягам — тихоокеанским лососям, обеспечивали в ледниковые периоды сохранение их популяций в реках субтропиков, а с появлением благоприятных климатических условий — мощный всплеск численности и быструю оккупацию северных акваторий. В периоды наступления ледников в северных районах своих ареалов, возможно, вымирали все тихоокеанские лососи. Горбуша, кета и сима в Амуре тоже периодически вымирали, но через десятки тысячелетий с наступлением потепления вновь заселяли Амур из рефугиумов.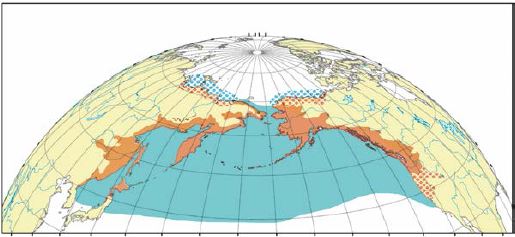
Рис. 9. Ареал горбуши: оранжевым показана репродуктивная часть ареала, синим – распространение в морской период жизни; точками обозначены районы редкой и эпизодической встречаемости (Шунтов, Темных, 2008)
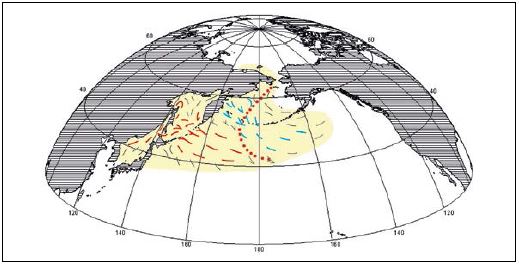
Рис. 10. Схема анадромных миграций азиатской горбуши: точечная линия — западная граница проникновения американских стад; красные стрелки — охотоморские и япономорские стада, синие — западноберинговоморские стада, черные — второстепенные направления миграций (Шунтов и др., 2010)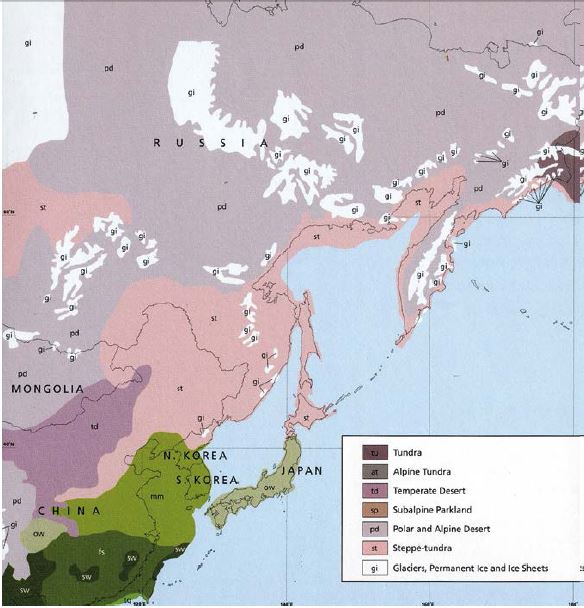
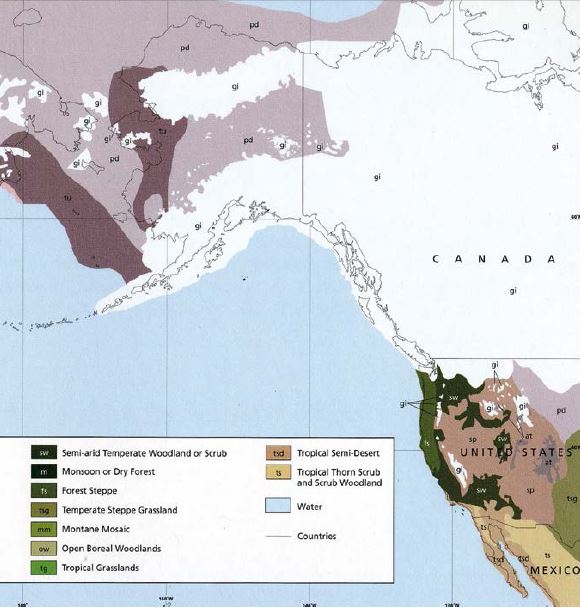
Рис. 11. Очертание береговой линии и распространение оледенения в последний ледниковый максимум 18 тыс. лет назад (Augerot et al., 2005)
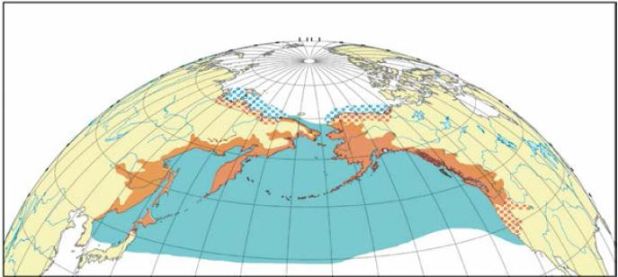
Рис. 12. Ареал кеты: оранжевым показана репродуктивная часть ареала, синим — распространение в морской период жизни; точками обозначены районы редкой и эпизодической встречаемости (Шунтов, Темных, 2008)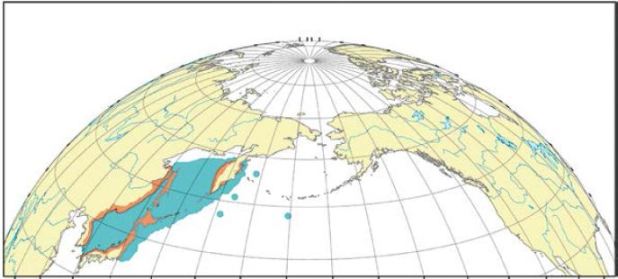
Рис. 13. Ареал симы: оранжевым показана репродуктивная часть ареала, синим – распространение в морской период жизни; кружками — единичные находки (Шунтов, Темных, 2008)